
分析 ①该反应中Na2S2O3既是氧化剂又是还原剂,氧化产物为二氧化硫,还原产物为S,然后利用化合价升降相等及质量守恒配平;
②该反应中Zn的化合价从0价升高为+2价的锌离子,硝酸根中+5价N降为氨根离子中-3价的氮,然后结合化合价升降相等配平.
解答 解:①反应中Na2S2O3的+2价的S化合价升高为0价的S单质,化合价升高2价;
Na2S2O3中+2价S又被氧化生成+4价的SO2,化合价降低2价,则化合价变化的最小公倍数为2,依据氧化还原反应化合价升降数目相等可知,S和SO2的系数都是1,然后依据原子个数守恒反应方程式为:Na2S2O3+2HCl=2NaCl+S+SO2↑+H2O,
故答案为:1;2;2;1;1;1;
②反应中0价的Zn的化合价从0价升高为+2价的锌离子,化合价升高2价;
硝酸根中+5价N降为氨根离子中-3价的氮,化合价降低8价,要使化合价升降数目相等,则锌的系数为4,硝酸根系数为1,依据原子个数守恒反应的方程式:4Zn+10H++NO3-=4Zn2++NH4++3H2O,
故答案为:4;10;1;4;1;3.
点评 本题考查了氧化还原反应的配平,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握配平氧化还原反应的方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:多选题
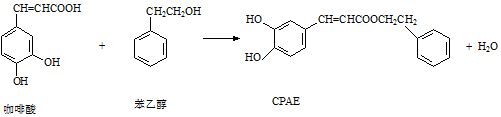
| A. | 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 | |
| B. | 1 mol CPAE最多可与含3 mol NaOH的溶液发生反应 | |
| C. | 不能用FeCl3溶液可以检测上述反应中是否有CPAE生成 | |
| D. | 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 硝基甲苯有领、间、对三种,其中对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5%NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
硝基甲苯有领、间、对三种,其中对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5%NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率 (%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 82.0 |
| 1.2 | 36.5 | 59.2 | 4.0 | 83.8 | |
NaHSO4 | 0.25 | 46.3 | 52.8 | 0.9 | 92.8 |
| 0.32 | 48.0 | 51.7 | 0.3 | 95.0 | |
| 0.36 | 45.0 | 54.4 | 0.6 | 93.9 | |
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小钠块 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在含有酚酞的水中加入一小块钠 | 钠浮在水面上,四处游动,发出嘶嘶响声,溶液变红 |
| D | 在空气中久置的铝条放入稀硫酸溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂物质的量之比为5:4 | |
| B. | 3 mol H2S可还原4mol的KIO3 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com