
| 1 |
| x |
| 42 |
| 28 |
| 2 |
| 3 |
| 1 |
| 3 |
| 4 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| [CO2]?[H2] |
| [CO]?[H2O] |
| ||||||||
|
| [CO2]?[H2] |
| [CO]?[H2O] |
(
| ||||
(
|
| 1.2mol |
| 3mol |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源:不详 题型:单选题
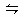 2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是( )
2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是( )| A.降温 | B.升温 | C.减压 | D.增压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
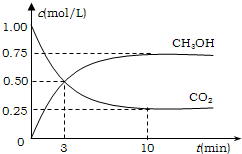
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
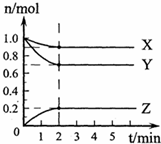
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.6mol | B.2.8mol | C.3.2mol | D.3.6mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
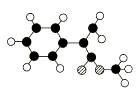
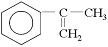 为主要原料合成A的路线如下:
为主要原料合成A的路线如下: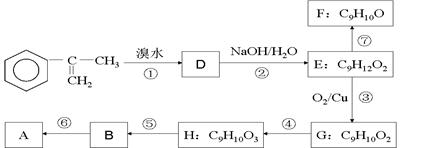
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com