
| m |
| M |
| 10.35g |
| 23g/mol |
| 0.45mol×1 |
| 2 |


科目:高中化学 来源: 题型:
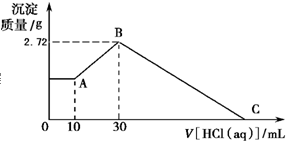
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和热的测定和蒸馏均需要温度计,且温度计水银球均插入反应液中 |
| B、中和热的测定和过滤均需要玻璃棒,且玻璃棒的作用均是引流 |
| C、中和热的测定和中和滴定,均是将一种反应物逐滴滴加到另一种反应物中 |
| D、中和热的测定实验中用60mL 0.50mol?L-1盐酸和50 mL0.55mol?L-1 NaOH溶液反应,与用50mL 0.50mol?L-1 盐酸和50ml 0.55mol?L-1 NaOH溶液反应所求中和热的数值相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清的石灰水跟盐酸反应:H++OH-═H2O |
| B、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
| D、金属钠跟水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
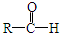 +R′-CH2-CHO→
+R′-CH2-CHO→ (其中R、R′为烃基,也可以是氢原子)产物不稳定,受热易脱水而生成不饱和醛.
(其中R、R′为烃基,也可以是氢原子)产物不稳定,受热易脱水而生成不饱和醛.
查看答案和解析>>
科目:高中化学 来源: 题型:
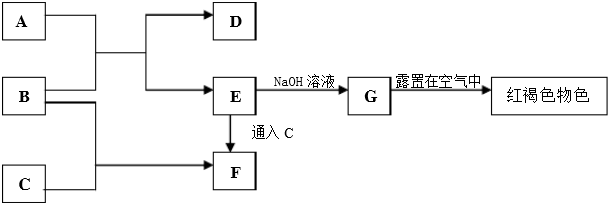
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com