
下列反应不能通过一步反应得到的是
| A.Na2CO3 → NaHCO3 | B.SiO2 →H2SiO3 |
| C.Fe(OH)2 → Fe(OH)3 | D.NH4Cl → NH3 |
科目:高中化学 来源: 题型:实验题
(17分)科学探究
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究。请按要求填写。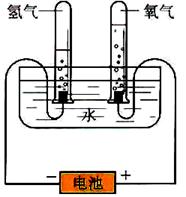
(1)观察不同时间试管内的H2和O2体积的比值均约为 。
(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成H2、O2的质量,计算过程如下:
并填表如下:
| | 质量g | 物质的量mol | H2和O2物质的量的比 |
| H2 | | | |
| O2 | | |
| 条件 | 物质 | 1 mol物质的体积 |
| 0℃101kPa | H2 | 22.3 L |
| O2 | 22.4 L | |
| CO2 | 22.4 L | |
| 25℃101kPa | H2 | 24.4L |
| O2 | 24.5L | |
| CO2 | 24.5L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(13分)已知HI是一种无色,有刺激性气味,极易溶于水的气体,HI的水溶液称之为氢碘酸,是一种强酸。
(1)请写出碘元素在周期表的位置:第五周期 族。
(2)将HI气体通入一定量的浓硫酸中,产生的混合气体除含HI、少量的I2蒸气和水蒸气外,还可能
有 气体。
(3)小明拟对HI通入浓硫酸后的混合气体成分进行验证和探究。他设计了如右实验装置图初步探究设计:
①其中直形玻璃管中所装的药品是 (写名称)
②足量四氯化碳的两个作用是: , 。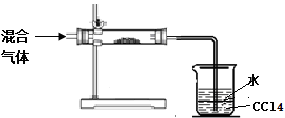
进一步探究:
查阅资料:氧化性强弱KMnO4>HNO3>I2>SO42-,且较稀的硝酸不能氧化I2。
③小明拟对溶在水层的其它混合气体成分做进一步探究。请你从以下限选试剂中选择合适的试剂帮小明完成实验报告。
限选的试剂:石蕊试剂、品红溶液、酸性KMnO4溶液、0.1mol/L HNO3、淀粉溶液、BaCl2溶液
| 实验方案 | 可能的现象和相应的结论 |
| 取少量烧杯中的上层溶液分装入A、B两支试管中 | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的分离方法不正确的是
| A.用过滤的方法除去食盐中泥沙 |
| B.用蒸馏的方法将海水淡化 |
| C.用酒精萃取碘水中的碘单质 |
| D.用加热的方法除去碳酸钠中的碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(9分)甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲 + H2O → 丙 + 丁
(1)转化关系中所涉及的反应为非氧化还原反应。
①若甲是一种钠盐,丁为两性氢氧化物,则甲的化学式为 ,丁的酸式电离方程式为 。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的电子式为 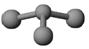
(2)转化关系中所涉及的反应为氧化还原反应。
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是 。
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热 |
| B.同温同压下,4Al(s)+3O2(g)===2Al2O3(s)在常温和点燃条件下的ΔH不同 |
| C.稀溶液中:H+(aq)+OH- (aq) ===H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ |
| D.由C(石墨)=== C(金刚石)△H= +1.90 kJ·mol-1 可知,金刚石比石墨稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com