
 金属是日常生活和工农业生产中广泛使用的材料.恰当的金属防腐方法是延长金属材料使用寿命的前提.
金属是日常生活和工农业生产中广泛使用的材料.恰当的金属防腐方法是延长金属材料使用寿命的前提.分析 (1)这两个反应必须在碱性条件下反应,结合元素守恒确定还需要试剂;根据反应物、生成物书写方程式;
(2)镀层为阳极、镀件为阴极,阳极上Zn失电子和氢氧根离子反应生成锌酸根离子和水,阴极上锌酸根离子失电子生成Zn;
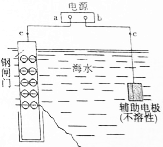
(3)外加电流保护法是金属防腐的重要方法,钢闸门作阴极被保护,则钢闸门应该连接原电池负极;辅助电极应该具有导电性且不易被氧化.
解答 解:(1)这两个反应必须在碱性条件下反应,结合元素守恒确定还需要试剂为NaOH;根据反应物、生成物书写方程式为2H2O+Na2FeO2+Na2Fe2O4=4NaOH+Fe3O4,故答案为:NaOH;2H2O+Na2FeO2+Na2Fe2O4=4NaOH+Fe3O4;
(2)镀层为阳极、镀件为阴极,阳极上Zn失电子和氢氧根离子反应生成锌酸根离子和水,阴极上锌酸根离子失电子生成Zn,电极反应式为ZnO22-+2H2O+2e-=Zn+4OH-,故答案为:阴极;ZnO22-+2H2O+2e-=Zn+4OH-;
(3)外加电流保护法是金属防腐的重要方法,钢闸门作阴极被保护,则钢闸门应该连接原电池负极,则a为负极;辅助电极应该具有导电性且不易被氧化,可以用石墨,故答案为:负极;石墨.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,涉及电解原理、金属腐蚀与防护、电镀等知识点,难点是反应方程式的书写,要结合电解质溶液酸碱性书写,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | 实验室常用Al2(SO4)3溶液与氨水溶液制备Al(OH)3沉淀 | Al(OH)3不溶于碱 |
| B | NaHCO3为强碱弱酸盐 | NaHCO3溶液显碱性 |
| C | SO2具有氧化性 | SO2可用品红溶液检验 |
| D | 明矾水解产生具有吸附性的胶体 | 明矾可作自来水消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将输油铁管埋在潮湿.疏松的土壤中 | |
| B. | 经常用自来水冲洗钢铁制品 | |
| C. | 将输送自来水的铁管表面镀锌 | |
| D. | 把钢铁雕塑焊接在铜质基座上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N | B. | O | C. | Na | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
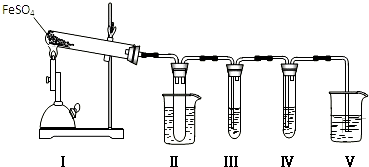
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5mol.L-1BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水). |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com