
醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
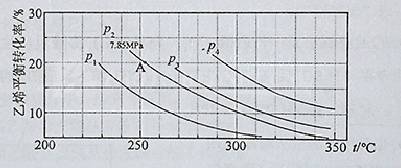
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
【答案】(1)C2H4+H2SO4= C2H5OSO3H; C2H5OSO3H+H2O=C2H5OH+ H2SO4;
(2) -45.5 污染小,腐蚀性小等;(3)①K=0.07(MPa)-1; ②P1< P2< P3< P4;反应分子数减少,相同温度下,压强升高,乙烯转化率提高; ③将产物乙醇液化转移去,增加n(H2O):n(C2H4)的比。
【解析】
试题分析:(1)根据题意可得乙烯与浓硫酸反应生成硫酸氢乙酯C2H5OSO3H的方程式:C2H4+H2SO4=  考点:考查化学方程式的书写、压强对平衡移动的影响、物质制取方案的设计与比较、反应热的计算、化学平衡常数的计算及提高产品产率的方法的探究的知识。
考点:考查化学方程式的书写、压强对平衡移动的影响、物质制取方案的设计与比较、反应热的计算、化学平衡常数的计算及提高产品产率的方法的探究的知识。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
使用氯化钠作原料可以得到多种产品。
(1)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的物质的量浓度是______________(忽略反应前后溶液体积的变化)。
(2)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置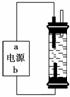 。对电源电极名称和消毒液的主要成分判断正确的是________(填字母序号)。
。对电源电极名称和消毒液的主要成分判断正确的是________(填字母序号)。
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
(3)实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。某同学利用上图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色。该同学换上的电解材料是__________(用元素符号表示),总的反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 |
某有机物的结构简式为(如右图),
则此有机物可发生的反应类型有 ( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和
A.①②③⑤⑥ B.②③④⑤⑥⑦ C.①③④⑤⑥ D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
莽草酸是合成治疗禽流感的药物——达菲的原料之一。莽草酸是A的一种异构体。A的结构式如下:
(1)A的分子式是
(2)A与溴的四氯化碳溶液反应的产物的结构简式是
(3)A与氢氧化钠反应的化学方程式(有机物用结构简式表示)是
(4)17.4 g A与足量碳酸氢钠溶液反应,生成二氧化碳的体积(标况下)为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
A.溴酸银的溶解时放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
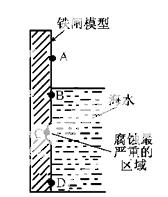
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
 ①步骤I若温度过高,将导致硝酸分解。硝酸分解的化
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化 学方程式为
学方程式为  。
。
②步骤II中发生反应:4Fe(NO3) 2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
构造原理揭示了电子排布能级顺序,实质是各能级能量高低,若以E表示同一原子中某能级的能量,下列能量大小顺序中正确的是
A.E(3s)>E(2s)>E(1s) B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)
查看答案和解析>>
科目:高中化学 来源: 题型:
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:
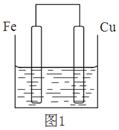 (以下均假设反应过程中溶液体积不变)。
(以下均假设反应过程中溶液体积不变)。
⑴铁片上的电极反应式为 。
⑵铜片周围溶液会出现 的现象。
⑶若2 min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为 mo1;
②该段时间内用硫酸铜表示的平均反应速率为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com