
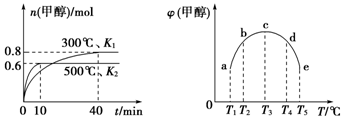
| A�� | �÷�Ӧ�ġ�H1��0����K1��K2 | |
| B�� | ������c�е�ƽ��״̬ת�䵽����d�е�ƽ��״̬���ɲ�ȡ�Ĵ�ʩ�����»��ѹ | |
| C�� | 300��ʱ����ƽ�����������ٳ���0.8 mol CO��0.6 mol H2��0.2 mol CH3OH��ƽ�������ƶ� | |
| D�� | 500��ʱ����ƽ�����������ٳ���1 mol CH3OH������ƽ���H2Ũ�ȺͰٷֺ��������� |
���� A������ͼ1���жϳ��¶ȶ�ƽ���Ӱ�죬��ͼ����Կ����������¶ȣ��״������ʵ������٣�˵������Ӧ�Ƿ��ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ���¶Ƚ��ͣ�ƽ�������ƶ���ƽ�ⳣ������
B����ƽ��״̬cת��d���״������½���˵��ƽ�������ƶ������Բ��ü�Сѹǿ�Ĵ�ʩ������ƽ��״̬���жϱ�־���жϣ�
C����������ʽ���м��㣻����ƽ�ⳣ���Ķ�����㣻300��ʱ�����ݻ�ѧƽ�����м���õ�ƽ��Ũ�ȣ�����õ����¶��µ�ƽ�ⳣ������ƽ�����������ٳ���0.8 mol CO��0.6 mol H2��0.2 mol CH3OH������Ũ���̺�ƽ�ⳣ���Ƚ��жϷ�Ӧ���еķ���
D.500��ʱ����ƽ�����������ٳ���1 mol CH3OH���൱������������ѹǿ��ƽ��������У�
��� �⣺A��ͼ1���Կ������״������ʵ���Ϊ0.6mol�������¶ȴ�˵�������¶ȣ��״������ʵ������٣���ƽ�������ƶ���˵������Ӧ�Ƿ��ȷ�Ӧ�����ԡ�H1��0��������Ӧ�Ƿ��ȷ�Ӧ���¶Ƚ��ͣ�ƽ�������ƶ���ƽ�ⳣ����������˵����ʱƽ�ⳣ����K1��K2����A����
B����ƽ��״̬cת��d���״������½���˵��ƽ�������ƶ������Բ��ü�Сѹǿ�Ĵ�ʩ��������ƽ��������еĴ�ʩ����B����
C����������ʽ���м��㣻����ƽ�ⳣ���Ķ�����㣬ƽ��״̬�¼״����ʵ���Ϊ0.8mol��
CO��g��+2H2��g��?CH3OH��g��
��ʼ����mol/L�� 1 2 0
�仯����mol/L�� 0.8 1.6 0.8
ƽ������mol/L��0.2 0.4 0.8
K=$\frac{0.8}{0.2��0��{4}^{2}}$=25
300��ʱ����ƽ�����������ٳ���0.8 mol CO��0.6 mol H2��0.2 mol CH3OH��Ũ����Qc=$\frac{0.8+0.2}{��0.8+0.2����0.4+0.6��^{2}}$=1��K��ƽ�������ƶ�����C��ȷ��
D.500��ʱ����ƽ�����������ٳ���1 mol CH3OH���൱������������ѹǿ��ƽ��������У�����ƽ���H2Ũ�������ٷֺ�����С����D����
��ѡC��
���� ���⿼�������ʵ�����ʱ��仯�����ߣ���Ŀ�Ѷ��еȣ�ע�������¶ȡ�ѹǿ�����ضԻ�ѧƽ���Ӱ�죬��ȷ����ͼ�������߱仯Ϊ���ؼ�������������ѧ�����Ӧ�û���֪ʶ��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �ö����ЧӦ����Fe��OH��3�����FeCl3��Һ | |
| B�� | Fe��OH��3����Ľ���������ɣ�ͨ��ʱ������ֱ����Դ�ĸ����ƶ������������Ϊ��Ӿ | |
| C�� | ���������ˮ��μӱ���FeCl3��Һ����Һ��������ɫʱ���õ�Fe��OH��3���� | |
| D�� | ����ڵ�NaOHϡ��Һ�бߵμ�FeCl3������Һ�����ò�����������Ȼ�������У��Ʊ�Fe��OH��3���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu | B�� | Fe | C�� | Al | D�� | Mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢ� | B�� | �ڢܢ� | C�� | �ڢܢ� | D�� | �ڢߢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ݻ����䣬�������ټ���1mol H2����Ӧ���ʼӿ죬����������Ӧ��������Ũ�ȣ���Ӧ���ʼӿ� | |
| B�� | ��������������ѹǿ���䣬�����м���1mol N2��N2���μӷ�Ӧ������Ӧ���ʼ����������DZ���ѹǿ���䣬�����г���N2��������Ӧ��Ũ�ȼ�С����Ӧ���ʼ��� | |
| C�� | ���������ݻ����䣬�����м���1mol N2��N2���μӷ�Ӧ������Ӧ���ʲ��䣬�����Ƿ�Ӧ���Ũ�Ȳ��䣬��Ӧ���ʲ��� | |
| D�� | ��������������ѹǿ���䣬�������ټ���1mol H2��g����1mol I2��g������Ӧ���ʼ�С������������������Ӧ��Ũ�ȱ�С����Ӧ���ʼ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ���¶���Һ����c��NH4+��•c��NH2-����һ������ | |
| B�� | Һ���к���NH3��NH4+��NH2-������ | |
| C�� | ֻҪ�������������ʣ�Һ����c��NH4+��=c��NH2-�� | |
| D�� | Һ���ﵽ����ƽ��ʱc��NH3��=c��NH4+��=c��NH2-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | BaCl2��ϡ���� | B�� | AgNO3��ϡ���� | C�� | ϡ���ᡢBaCl2 | D�� | AgNO3��ϡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮʱ��ƽ�����淴Ӧ�����ƶ� | |
| B�� | ��������0.1 mol/L HCl��Һ����Һ��c��H+������ | |
| C�� | ��������NaOH���壬ƽ��������Ӧ�����ƶ� | |
| D�� | ��������CH3COONa���壬ƽ��������Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com