
| A. | 甲醛量太少 | B. | 硫酸铜量少 | C. | NaOH量少 | D. | 加热时间短 |
分析 甲醛和新制的Cu(OH)2反应的本质是:甲醛中具有还原性的醛基,被新制的氢氧化铜氧化,即醛基与氢氧化铜中的+2价的铜发生氧化还原反应,操作的关键是在碱性环境下进行,即碱要过量.
解答 解:该反应的本质是:甲醛中具有还原性的醛基,被新制的氢氧化铜氧化,即醛基与氢氧化铜中的+2价的铜发生氧化还原反应,只要有醛基即可反应,且加热至煮沸即可,本实验中试剂的量:n(CuSO4)=1mol/L×0.002L═0.002mol,n(NaOH)=0.5mol/L×0.004L═0.002mol,
根据反应:CuSO4+2NaOH═Cu(OH)2↓+2NaSO4,可知:硫酸铜过量,而本实验要求碱过量,所以NaOH量少,
故选C.
点评 本题考查了有机物醛类和新制的Cu(OH)2反应的实验,碱要过量是实验的关键条件,题目难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 铜粉溶解 | 金属铜比铁活泼 |
| B | 将pH试纸放在玻片上,用玻璃棒蘸取某新制氯水,点在pH试纸中央,与标准比色卡对照 | pH=2 | 氯气与水反应生成了强酸 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将KI和FeCl3溶液在试管中混合后,加入汽油,振荡,静置 | 下层溶液显紫红色 | 生成的I2全部溶于汽油中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙试液变红的溶液中:Al3+ Cu2+NO3-SO42- | |
| B. | pH>7的溶液中:Na+Mg2+SO42-I- | |
| C. | 由水电离出的c(H+)=l.0×10-13 mol•L-1的溶液中:Na+CO32-SO32-Cl- | |
| D. | 加铝粉能产生大量H2的溶液中:Na+NH4+NO3-Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
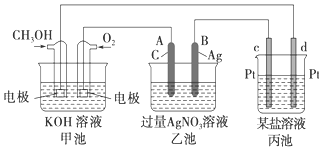 化学在能源开发与利用中起到十分关键的作用.甲醇是一种新型的绿色能源,又是一种重要的化工原料.甲醇燃料电池能量转化率高,具有广阔的发展前景.现用甲醇燃料电池进行如图实验.已知:2CH3OH+3O2+4OH-═2CO32-+6H2O
化学在能源开发与利用中起到十分关键的作用.甲醇是一种新型的绿色能源,又是一种重要的化工原料.甲醇燃料电池能量转化率高,具有广阔的发展前景.现用甲醇燃料电池进行如图实验.已知:2CH3OH+3O2+4OH-═2CO32-+6H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | MgO熔点高,可用作耐高温材料 | |
| C. | KAl(SO4)2•12H2O易溶于水,可用作净水剂 | |
| D. | NH4Cl受热易分解,可用作氮肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com