
| A. | 下列转化均能一步实现:粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | 元素C的单质只存在金刚石和石墨两种同素异形体 | |
| C. | 硬度:晶体硅<金刚石 | |
| D. | 高温下用焦炭还原SiO2制取粗硅 |
分析 A.粗硅和氯气反应生成四氯化硅,四氯化硅和氢气反应生成硅和水;
B.C元素的单质存在多种同素异形体;
C.原子晶体中,键长越短,键能越大,则硬度越大;
D.碳还原二氧化硅生成硅和一氧化碳;
解答 解:A.粗硅和氯气反应生成四氯化硅,四氯化硅和氢气反应生成硅和水,转化均能一步实现,故A正确;
B.元素C除存在金刚石和石墨外,还存在足球烯(C60)等同素异形体,故B错误;
C.晶体硅与金刚石都为原子晶体,其中化学键的键长为:C-C<Si-Si,原子晶体中,键长越短,键能越大,则硬度越大,故C正确;
D工业上在.高温下用焦炭还原SiO2制取粗硅,碳和二氧化硅反应生成硅和一氧化碳,故D正确;
故选B.
点评 本题考查了硅、二氧化硅等物质性质和结构的分析判断,掌握基础是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
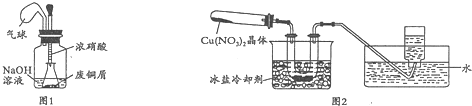
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
| 样品中碱式碳酸铜的质量分数/% | 90.9 | 92.7 | x | 92.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 医疗上常用75%的酒精杀菌消毒 | |
| B. | 由于分子间氢键的存在,NH3易液化,H2O常温下呈液态 | |
| C. | 雾霾公益调查纪录片《穹顶之下》的发布引起了人们的关注,雾霾属于胶体 | |
| D. | 氢气是理想的绿色能源,贮氢合金的发现和应用解决了氢气贮存运输的难题,贮氢金属与氢气发生化学反应,形成氢化物,达到贮存氢气的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用煮沸的方法可使医疗器械消毒 | |
| B. | 用福尔马林保存生物标本 | |
| C. | 鸡蛋白溶液里加入饱和硫酸铵溶液,可以观察到有沉淀析出 | |
| D. | 鸡蛋白溶液里加入少量乙酸铅溶液,可以观察到有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 是否能形成丁达尔效应是胶体和溶液最本质的区别 | |
| B. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 | |
| C. | “雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的知识有关 | |
| D. | 除去Fe(OH)3胶体中的FeCl3,可将混合物装入半透膜中,放入蒸馏水里 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸保存在无色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | NaOH溶液保存在具有玻璃塞的玻璃试剂瓶中 | |
| D. | 新制氯水保存在棕色玻璃试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com