
| A. | NaCl(固)+HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaNO3+HCl↑ | |
| B. | NaBr(固)+H3PO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaH2PO4+HBr↑ | |
| C. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI | |
| D. | CaF2+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CaSO4+2HF↑ |
分析 A、浓硝酸易分解,且易挥发;
B、磷酸不挥发,且无强氧化性;
C、氢气和碘的反应为可逆反应;
D、浓硫酸不挥发.
解答 解:A、浓硝酸易分解,且易挥发,故不能用于制取HCl,应用氯化钠固体和浓硫酸反应来制取,故A错误;
B、磷酸不挥发,且无强氧化性,不会将生成的HBr氧化,故可以用溴化钠固体和浓磷酸反应来制取HBr,故B正确;
C、氢气和碘的反应为可逆反应,不能进行彻底,故制取的HI中含有氢气和碘蒸气,故不能用此法来制取HI,故C错误;
D、浓硫酸不挥发,且不能将生成的HF氧化,故制取HF气体用氟化钙固体和浓硫酸,故D正确.
故选BD.
点评 本题考查了卤代烃的制备,应注意在制备卤代烃时,应注意选用的酸需是不挥发性酸,且不能将生成的HX氧化.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
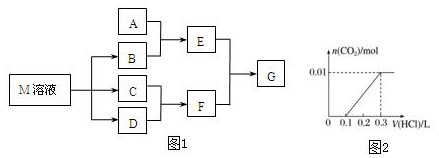

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ②⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、CO32- | B. | K+、NO3-、Cl- | ||
| C. | Na+、Fe3+、OH- | D. | Ba2+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 制备方法 | 化学共沉淀法 | 碾磨法 | 蒸着(zhuó)法 |
| 制得磁流体颗粒直径 | 大约40纳米左右 | 大于300纳米 | 2-10纳米 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.15 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.25 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:填空题
⑴反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g) CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
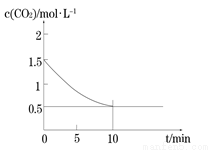
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为_________mol·L-1。
②下列措施中能使平衡时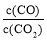 增大的是_________(填序号)。
增大的是_________(填序号)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com