
【题目】另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应).
(1)步骤一:电解精制:电解时,粗铜应与电源的极相连.阴极上的电极反应式为 .
(2)步骤二:电解完成后,该小组同学按以下流程对电解液进行处理: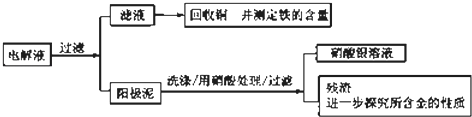
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: , 残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
序号 | 反应 | 平衡常数 |
1 | Au+6HNO3Au(NO3)3+3NO2↑+3H2O | <<1 |
2 | Au3++4Cl﹣AuCl4- | >>1 |
请根据以上信息简要解释溶解阳极泥不用王水的原因 .
②滤液含量的测定:以下是该小组探究滤液的一个实验流程.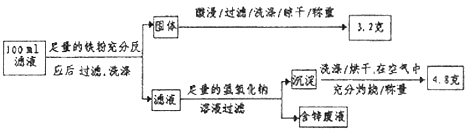
则100mL滤液中Cu2+的浓度为 molL﹣1 , Fe2+的浓度为 molL﹣1 .
【答案】
(1)正;Cu2++2e=Cu
(2)3Ag+4H++NO3﹣=3Ag++NO↑+2H2O;浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4﹣离子,使反应2平衡向右移动,则金溶于王水中;0.5;0.1
【解析】解:步骤一:在电解精炼铜时,阳极反应是金属锌、铁、镍等先失电子,阴极上是铜离子得电子产生铜,精铜做阴极,粗铜作阳极,所以答案是:正;Cu2++2e=Cu;步骤二:(1)金属银可以和稀硝酸反应生成硝酸银、一氧化氮和水,即3Ag+4H++NO3﹣=3Ag++NO↑+2H2O;根据表中的信息,Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,并且Au3++4Cl﹣=AuCl4﹣ , 在王水中,含有浓硝酸和浓盐酸,浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4﹣离子,使反应2平衡向右移动,则金溶于王水中,所以答案是:3Ag+4H++NO3﹣=3Ag++NO↑+2H2O;浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4﹣离子,使反应2平衡向右移动,则金溶于王水中;(2)100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所以生成的3.2g金属是Cu,所以铜离子的浓度c= ![]() =
= ![]() =mol/L=0.5 mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是:
=mol/L=0.5 mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是: ![]() ×2=0.06mol,所以加入铁粉后的滤液中亚铁离子的浓度c=
×2=0.06mol,所以加入铁粉后的滤液中亚铁离子的浓度c= ![]() =
= ![]() =0.6mol/L,由于加入了铁粉,铁与溶液中的铁离子反应生成了亚铁离子,所以100mL滤液中亚铁离子的浓度为:0.6mol/L﹣0.5 mol/L=0.1mol/L,所以答案是:0.5;0.1.
=0.6mol/L,由于加入了铁粉,铁与溶液中的铁离子反应生成了亚铁离子,所以100mL滤液中亚铁离子的浓度为:0.6mol/L﹣0.5 mol/L=0.1mol/L,所以答案是:0.5;0.1.


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是
A.液氨和干冰均可作制冷剂
B.CaO 和 CaCl2 ·6H2O 均可作食品干燥剂
C.ClO2和臭氧均可作自来水的消毒剂
D.铁粉与和维生素 C 均可作食品袋内的脱氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2===6NH4Cl+N2,回答下列问题:
(1)该反应的氧化剂是_______________ ,还原剂是________________。
(2)氧化剂与还原剂的物质的量之比为________________。
(3)当有34 g NH3被氧化时,参加反应的氯气的质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下纯水中的c(H+)=2×10﹣7molL﹣1 , 则此时水中的c(OH﹣)=;若温度不变,滴入稀盐酸,使c(H+)=5×10﹣4molL﹣1 , 则此时溶液中由水电离产生的c(OH﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下的理想气体,影响其所占体积大小的主要因素是( )
A. 分子数目的多少 B. 分子直径的大小 C. 分子间引力的大小 D. 分子间距离的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验.
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是 .
(2)装置乙中正极的电极反应式是 .
(3)装置丙中溶液的pH(填“变大”、“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 .
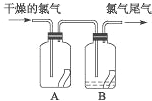
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气,原理是(用化学方程式表示) .根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是 (填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是 (用字母代号填).
A.O2 B.Cl2 C.CO2 D.HClO.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则m g Na与氧气反应,生成固体的质量可能为
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.8)g
A. 仅①④ B. 仅①⑤ C. 仅③④ D. 仅①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com