
分析 钠离子浓度与溶液体积大小无关,根据硫酸钠的浓度及其化学式计算出钠离子的物质的量浓度;根据n=cV计算出硫酸钠的物质的量,再根据m=nM计算出硫酸钠的质量.
解答 解:升0.3mol/L的Na2SO4溶液中含有钠离子的浓度为:c(Na+)=2c(SO42-)=0.3mol/L×2=0.6mol/L;
该溶液中含有的硫酸钠的物质的量为:n(Na2SO4)=0.3mol/L×1L=0.3mol,
溶液中含有硫酸钠的质量为:m(Na2SO4)=142g/mol×0.3mol=42.6g,
故答案为:0.6mol/L;42.6g.
点评 本题考查了物质的量浓度的计算,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度的关系,明确离子的浓度与溶液体积无关,与溶质的浓度、化学式组成有关,为易错点,试题培养了学生的化学计算能力.


科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。则下列各项正确的是
A.混合前:pH(CH3COOH)+pH(NaOH)=14
B.混合后:c(Na+)=c(CH3COO-)+c(OH-)
C.混合前:c(CH3COOH)>c(NaOH)
D.混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
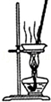 | 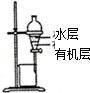 |
| A.装置可用于蒸干氯化铝溶液制AlCl3 | B.装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
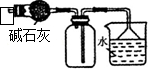 | 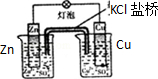 |
| C.装置可用于收集NH3或HCl气体,并防止倒吸 | D.装置盐桥中的K+自右向左移动 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
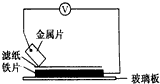 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D| A.在四种金属中C的还原性最弱 |
| B.金属B能从硫酸铜溶液中置换出铜 |
| C.AD若形成原电池时A为正极 |
| D.AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| B. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com