
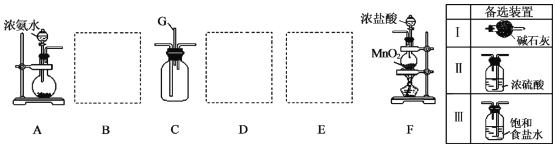
分析 (1)二氧化锰可以和浓盐酸在加热条件下生成氯气,根据离子方程式的书写方法来书写;
(2)根据装置可知,A中用浓氨水与碱石灰制氨气,碱石灰吸收氨水中的水,同时放热使氨气挥发出来;
(3)根据杂质的性质选择除杂装置;
(4)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质是氮气,两者发生归中反应,方程式为:4NH3+6NO═5N2+6H2O;消耗标准状况下1molNH3转移电子为3mol.
解答 解:(1)二氧化锰可以和浓盐酸在加热条件下生成氯气,反应的实质为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O;
(2)根据装置可知,A中用浓氨水与碱石灰制氨气,碱石灰或生石灰吸收氨水中的水,同时放热使氨气挥发出来,反应方程式可表示为NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:A、B;
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ.
故答案为:Ⅰ;Ⅱ;Ⅲ;
(4)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质是氮气,两者发生归中反应,方程式为:4NH3+6NO═5N2+6H2O;消耗标准状况下1molNH3转移电子为3mol,所以8.96LNH3的物质的量为:0.4mol,所以转移电子的物质的量为:1.2mol,
故答案为:4NH3+6NO═5N2+6H2O;1.2.
点评 本题考查了氯气、氨气的实验室制备及性质检验,把握实验装置的作用、物质的性质为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 根据实验①可知溶液中不存CO32-、SiO32- | |
| B. | 该溶液中肯定存在NH4+、Fe2+ | |
| C. | 该溶液中至少含有4种离子 | |
| D. | 另取该溶液,加入适量氯水和淀粉溶液,若溶液显蓝色,即可确定该溶液中只含NH4+、Fe2+、Fe3+、SO42-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| B. | Y的氢化物比R的氢化物稳定,沸点高 | |
| C. | Y分别与Z、W、R以两种元素组成的常见化合物有3种 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
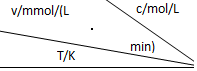 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=6.00 | |
| B. | 不同温度时,蔗糖浓度减少一半所需的时间相同 | |
| C. | b<318.2 | |
| D. | 同时改变反应温度和蔗糖的浓度,v可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | 向某溶液中滴入2滴KSCN溶液,溶液不显血红色.再向溶液中滴入几滴新制的氯水,溶液变为血红色 | 该溶液中一定含有Fe2+ |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl,2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>2ClO3->IO3- |
| D | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3所含有的原子数为NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48 g O3所含的氧原子数为3NA | |
| D. | 0.1 molNa+中所含的电子为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com