
【题目】铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图: 
已知:部分物质沉淀的pH如表:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
请回答下列问题:
(1)滤液I中所含溶质主要有(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为 , 然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为 .
(3)当离子浓度≤1×10﹣5molL﹣1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 . (已知:Kap[Cr(OH)3]=6.3×10﹣31 , ![]() ≈4.0;lg4=0.6)
≈4.0;lg4=0.6)
(4)Cr(OH)3受热分解为Cr2O3 , 用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式 .
【答案】
(1)Fe2(SO4)3、Cr2(SO4)3、CuSO4
(2)3.2≤pH<4.3;Fe(OH)3、CaSO4
(3)5.6
(4)Cr2O3+2Al ![]() Al2O3+2Cr
Al2O3+2Cr
【解析】解:向泥料中加入稀硫酸,发生反应Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、CuO+H2SO4=CuSO4+H2O、Cr2O3+3H2SO4=Cr2(SO4)3+3H2O,然后过滤得到滤渣I和滤液I,滤液I中溶质为Fe2(SO4)3、Cr2(SO4)3、CuSO4 , 向滤液中加入Ca(OH)2 , 并调节溶液pH,根据流程图中滤液II中含有Cr3+、Cu2+ , 不含Fe3+ , 说明滤渣II中含有Fe(OH)3 , 硫酸钙属于微溶物,所以沉淀II成分为Fe(OH)3、CaSO4 , 要使Cr3+、Cu2+不沉淀而Fe3+发生沉淀,根据离子生成沉淀需要pH值知,溶液的pH范围为3.2﹣4.3之间;向滤液中加入NaHSO3 , 亚硫酸氢钠具有还原性、铜离子具有氧化性,二者发生氧化还原反应生成硫酸和砖红色沉淀Cu2O,硫酸和亚硫酸氢根离子反应生成二氧化硫,离子方程式为2H2O+HSO3﹣+2Cu2+=Cu2O↓+SO42﹣+5H+、HSO3﹣+H+=SO2↑+H2O,过滤得到Cu2O,向滤液中加入NaOH并调节溶液pH,发生反应Cr3++3OH﹣=Cr(OH)3↓,滤液IV中含有NaOH、Na2SO4 , (1)通过以上分析知,滤液I中溶质成分为Fe2(SO4)3、Cr2(SO4)3、CuSO4 , 所以答案是:Fe2(SO4)3、Cr2(SO4)3、CuSO4;(2)Fe3+完全沉淀需要的pH≥3.2,pH=4.3时Cr3+开始产生沉淀,要使铁离子完全沉淀而其它离子不沉淀,则pH范围为:3.2≤pH<4.3,通过以上分析知,沉淀II成分为Fe(OH)3、CaSO4 , 所以答案是:3.2≤pH<4.3; Fe(OH)3、CaSO4;(3)当离子浓度≤1×10﹣5molL﹣1时,可以认为离子沉淀完全,若要使Cr3+完全沉淀,则c(Cr3+)≤1×10﹣5molL﹣1 , c(OH﹣)= ![]() =
= ![]() mol/L=4.0×10﹣9 mol/L,c(H+)=
mol/L=4.0×10﹣9 mol/L,c(H+)= ![]() =2.5×10﹣6mol/L,则溶液的pH=﹣lg2.5×10﹣6=5.6,
=2.5×10﹣6mol/L,则溶液的pH=﹣lg2.5×10﹣6=5.6,
所以答案是:5.6;(4)Cr2O3和Al高温下发生铝热反应生成氧化铝和Cr,反应方程式为Cr2O3+2Al ![]() Al2O3+2Cr,所以答案是:Cr2O3+2Al
Al2O3+2Cr,所以答案是:Cr2O3+2Al ![]() Al2O3+2Cr.
Al2O3+2Cr.


科目:高中化学 来源: 题型:
【题目】如图甲、乙是电化学实验装置.
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液.①甲中石墨棒上的电极反应式 , 电子的移动方向为 .
②乙中总反应的离子方程式为 , Cl﹣移向电极(填Fe或C).
③将湿润的淀粉﹣KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2 . 若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为: .
(2)如果起始时乙中盛有200mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入CuO的质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
A.0.1mol﹣NH2(氨基)中含有的电子数目为1.0NA
B.常温下,1L 0.1molL﹣1 CH3COONa溶液中含有的CH3COO﹣和Na+总数为0.2NA
C.标准状况下,2.24 LH2O中含有的原子总数为3NA
D.常温常压下,16 g O2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)C(g)+D(s)反应的平衡常数与温度的关系如下:
温度℃ | 700 | 800 | 880 | 1000 | 1200 |
平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 则2min时c(A)=molL﹣1 , C的物质的量为mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有 a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃ 时,反应 C(g)+D(s)A(g)+B(g)的平衡常数的值为 .
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图 . 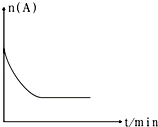
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀.
A. ①④⑥ B. ②③⑤ C. ②③④ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、![]()
B. 通入过量SO2气体后的溶液:H+、Ca2+、Fe3+、![]()
C. 通入足量CO2的溶液:H+、![]() 、Al3+、
、Al3+、![]()
D. 与铝反应产生大量氢气的溶液:Na+、K+、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com