
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
a |
|
|
|||||||||||||||
|
b |
|
|
|
c |
d |
e |
f |
|
|||||||||
|
g |
h |
i |
j |
|
k |
l |
m |
||||||||||
|
n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出:元素o的基态原子电子排布式 。
(2)k在空气中燃烧产物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(3)含10电子的d的氢化物分子的VSEPR模型为 。元素c、a、e按原子个数1:2:1组成生活中常见有甜味分子,该分子中有 个手性碳原子。
(4)g、h、i三种元素的第一电离能由大到小的顺序为 (填元素符号)。
(5)所有元素中电负性最大的是 (填图中序号所示的元素符号),元素k有两种氧化物,它们对应的水化物的酸性强弱顺序为 。(填化学式)
(1)1s22s22p63s23p63d64s2 (2)V形, sp2杂化, 极性
(3)四面体形, 4 (4)Mg>Al>Na (5)F, H2SO4>H2SO3
【解析】
试题分析:(1)根据元素在周期表中的相对位置可知,元素o位于第四周期第Ⅷ族,是26号元素铁。则根据构造原理可知,元素铁的基态原子电子排布式为)1s22s22p63s23p63d64s2。
(2)k位于第三周期第ⅥA族,是硫元素。单质硫在空气中燃烧产物是SO2。根据价层电子对互斥理论可知,SO2分子中S原子含有的孤对电子对数=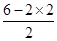 =1,因此SO2是V型结构,属于极性分子,S原子是sp2杂化。
=1,因此SO2是V型结构,属于极性分子,S原子是sp2杂化。
(3)d元素位于第二周期第ⅤA族,因此含10电子的N的氢化物分子是NH3。根据价层电子对互斥理论二者,N原子含有的孤对电子对数=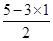 =1,因此氨气分子的VSEPR模型为四面体形。元素c、a、e分别是C、H、O三种元素,按原子个数1:2:1组成生活中常见有甜味分子是葡萄糖。由于将连有四个不同基团的碳原子形象地称为手性碳原子(常以*标记手性碳原子),所以根据葡萄糖的结构简式CH2OH(CHOH)4CHO可知,该分子中间的4个碳原子均是手性碳原子,所以含有4个手性碳原子。
=1,因此氨气分子的VSEPR模型为四面体形。元素c、a、e分别是C、H、O三种元素,按原子个数1:2:1组成生活中常见有甜味分子是葡萄糖。由于将连有四个不同基团的碳原子形象地称为手性碳原子(常以*标记手性碳原子),所以根据葡萄糖的结构简式CH2OH(CHOH)4CHO可知,该分子中间的4个碳原子均是手性碳原子,所以含有4个手性碳原子。
(4)g、h、i三种元素位于第三周期,分别是Na、Mg、Al。同周期自左向右金属性逐渐减弱,第一电离能逐渐增大。但由于Mg元素的3s电子处于全充满状态,稳定性强于Al元素的,因此镁的第一电离能大于铝元素的第一电离能,所以三种元素的第一电离能由大到小的顺序为Mg>Al>Na。
(5)同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱。由于非金属性越强,电负性越大,所以所有元素中电负性最大的是是第二周期第 ⅦA族的F元素。元素S有两种氧化物,它们对应的水化物分别是亚硫酸和硫酸,化学式分别是H2SO3、H2SO4。在含氧酸中(HO)mROnn值越大,酸性越强,由于亚硫酸和硫酸分别可写成(HO)2RO、(HO)2RO2,所以硫酸的酸性强于亚硫酸的酸性,即酸性强弱顺序为H2SO4>H2SO3。
考点:考查元素周期表的结构、元素周期律的应用;核外电子排布、分子的空间构型、杂化轨道类型、第一电离能比较、手性碳原子判断以及含氧酸酸性强弱比较等


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | |||||||||||||
| F | G | H | |||||||||||||||
| I | J | K | |||||||||||||||
| L | |||||||||||||||||
| M | N | ||||||||||||||||
| O | |||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | ||||||||||||||
| i | |||||||||||||||||
| j | |||||||||||||||||


 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 主族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com