
| 选项 | 操作 | 现象 | 结论 |
| A | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 无色溶液中滴加氯水和CC14,振荡、静置 | 下层溶液呈紫色 | 原溶液中有I- |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水高温下反应 |
| A. | A、 | B. | B | C. | C | D. | D |
分析 A.观察K的焰色反应需要透过蓝色的钴玻璃;
B.常温下将Al片放入浓硝酸中,发生钝化;
C.由现象可知,氯气氧化碘离子生成碘单质;
D.铁与水蒸气反应生成四氧化三铁和氢气.
解答 解:A.由操作可现象为黄色可知,一定含Na+,不能确定是否含K+,结论不合理,故A不选;
B.常温下将Al片放入浓硝酸中,发生钝化,生成致密的氧化膜阻止反应的进一步发生,结论不合理,故B不选;
C.由现象可知,氯气氧化碘离子生成碘单质,则原溶液中有I-,故C选;
D.铁与水蒸气反应生成四氧化三铁和氢气,可知现象为黑色固体生成,现象不合理,故D不选;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、物质的性质、反应及现象、实验技能等为解答关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | NaOH 溶液、浓 H2SO4 | 洗气 |
| B | NH4Cl (aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | Fe粉 | Al粉 | NaOH溶液 | 过滤 |
| D | Na2CO3(s) | NaHCO3(s) | - | 灼烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈碱性 | B. | 呈酸性 | C. | 呈中性 | D. | c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠和水反应 | B. | 氧化钠和水反应 | ||
| C. | 过氧化钠和水反应 | D. | CO2+H2O+Na2CO3=2NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,用玻璃棒搅动滤纸中的液体 | |
| B. | 做钠的焰色反应实验可用玻璃棒蘸取少量NaCl的浓溶液在无色火焰上灼烧 | |
| C. | 配制溶液过程中定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线 | |
| D. | 用自来水制蒸馏水时,弃去开始馏出的部分液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤法 | B. | 蒸馏法 | C. | 萃取法 | D. | 结晶法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g的金刚石晶体中含有碳碳键的数目为4NA | |
| B. | 46g四氧化二氮含有的原子总数一定为3NA | |
| C. | 500mLl.0mol/L的乙酸溶液中含有的H+数为0.5NA | |
| D. | 1 molFeCl3制成胶体,所得胶体的粒子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 | |
| B. | 0.1 mol•L-1醋酸溶液中:c2(H+)=c(H+)•c(CH3COO-)+KW | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)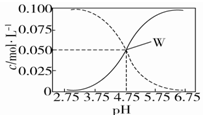 | |
| D. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com