
【题目】不同温度下,三个体积均为1L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
容器编号 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | ||||
CH4 | NO2 | N2 | CO2 | H2O | NO2 | ||
I | T1 | 0.50 | 1.2 | 0 | 0 | 0 | 0.40 |
II | T2 | 0.30 | 0.80 | 0.20 | 0.20 | 0.40 | 0.60 |
III | T3 | 0.40 | 0.70 | 0.70 | 0.70 | 1.0 | |
A.T1<T2
B.若升高温度,正反应速率减小,逆反应速率增大,平衡逆移
C.平衡时,容器I中反应放出的热量为693.6 kJ
D.容器III中反应起始时v 正(CH4) <v逆(CH4)
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式满足C6H12的有机物所有碳原子可能位于同一平面上
B.1mol乙烷在光照条件下最多能与3molCl2发生取代反应
C.甲烷、苯和油脂均不能使酸性KMnO4溶液褪色
D.分子式为C4H10O且能与金属钠反应的有机物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
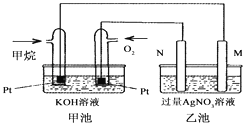
(1)M电极的材料是________,其电极反应式为:________N的电极名称是________,电极反应式为:________
(2)通入甲烷的铂电极的电极反应式为________.
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为________ L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)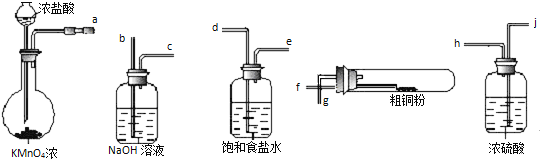
①按气流方向连接各仪器接口顺序是:![]() ______ .
______ .
②反应时,盛粗铜粉的试管中的现象是 ______ .
③已知:氯化铜溶液中有如下转化关系:
![]()
![]()
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 ______ ![]() 填序号
填序号![]() .
.
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入![]() 晶体,溶液变为绿色
晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释对应事实的离子方程式正确的是
A.FeSO4溶液中滴加NaOH溶液,静置一段时间后:Fe2++2OH一=Fe(OH)2↓
B.漂白粉溶液加入醋酸:H++ClO-=HC1O
C.AgCl悬浊液滴入Na2S溶液:2Ag++S2-=Ag2S↓
D.K2 CrO4溶液滴入硫酸溶液;2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列过程与氧化还原反应无关的是( )
A.酸性重铬酸钾用于检测酒精
B.铝粉与强碱溶液反应放热
C.植物油在空气中变质,产生“哈喇”味
D.海水经风吹日晒获得粗盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)铜晶体铜碳原子的堆积方式如图所示。
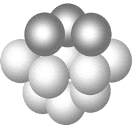
①基态铜在元素周期表中位置__________________。
②每个铜原子周围距离最近的铜原子数目_________。
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
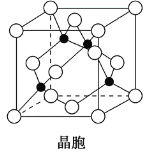
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,发生反应N2(g)+3H2(g)![]() 2NH3(g) ΔH= 92.4kJ/mol,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= 92.4kJ/mol,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 0.5mol N2、1.5mol H2 | 1mol NH3 | 2mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
吸收或放出的热量(kJ) | a | b | c |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | ɑ1 | ɑ2 | ɑ3 |
下列说法正确的是
A.a + b = 46.2B.2c1>c3>c1C.2p2<p3D.ɑ1+ɑ3>1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com