
| A、原子半径呈周期性变化 |
| B、元素化合价呈周期性变化 |
| C、电子层数逐渐增加 |
| D、元素原子的核外电子排布呈周期性变化 |


科目:高中化学 来源: 题型:
| A、可用碳酸钠与醋酸制取少量二氧化碳 |
| B、泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫 |
| C、厨房中常用碳酸钠溶液洗涤餐具上的油污 |
| D、实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
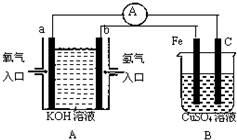 根据如图所示装置回答问题:
根据如图所示装置回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:Sn4+<Sn2+ |
| B、氧化性:Fe3+<Sn4+ |
| C、还原性:Fe2+<Sn2+ |
| D、还原性:Fe<Sn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、金属铝投入NaOH溶液中:Al+2OH-=AlO2-+H2↑ |
| C、稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| D、FeCl2酸性溶液放在空气中变质:4Fe2++4H++O2=4Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
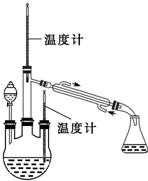 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度该反应的正反应速率增大,逆反应速率减小 | ||
B、该反应的化学平衡常数表达式为K=
| ||
| C、绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 | ||
| D、该反应的正反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com