
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:
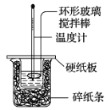
(1)做1次完整的中和热测定实验,温度计至少需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?_______________。
(2)实验室用50 mL 0.50 mol·L-1盐酸,50 mL 0.55 mol·L-1 NaOH溶液进行测定中和热的实验,为了把测量数据记录下来,请你设计表格__________。
【答案】3不同意,因为不同的温度计误差不同
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | |||||
2 | |||||
3 | |||||
【解析】
(1)温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度,因此一共3次;由于不同温度计的误差不同,所以实验时不能使用两支温度计分别测量酸和碱的温度;
(2)中和热的实验原理:温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,求出两者的平均值,混合反应后测最高温度一共3次,最后求出温度差,为了减少误差应重复2-3次,所以表格为:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | |||||
2 | |||||
3 | |||||
。


科目:高中化学 来源: 题型:
【题目】下列实验操作和实验结论均正确的是
实验操作 | 实验结论 | |
A | 先加少量氯水,再滴加KSCN溶液,出现血红色 | 证明某溶液中存在Fe2+ |
B | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸钙中滴加盐酸,有气泡产生 | 证明氯的非金属性大于碳 |
D | 将MgCl2溶液在氯化氢的气流中蒸发、结晶、过滤 | 制备氯化镁晶体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的叙述中正确的是( )
A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料元素
B. 在过渡元素中可以寻找制备催化剂
C. 在元素周期表的右上角可以寻找制备耐高温和耐腐蚀的元素
D. 在地球上元素的分布和它们在元素周期表中的位置有密切关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N0表示阿伏加德罗常数的值,下列说法正确的是
A. 1g H2所含分子数为N0
B. 2g D2O中所含的质子数为N0
C. 0.5 mol/L Na2SO4溶液中所含Na+ 数为N0
D. 标准状况下,4.48 L CCl4所含原子数为N0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和实验结论均正确的是
实验操作 | 实验结论 | |
A | 先加少量氯水,再滴加KSCN溶液,出现血红色 | 证明某溶液中存在Fe2+ |
B | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸钙中滴加盐酸,有气泡产生 | 证明氯的非金属性大于碳 |
D | 将MgCl2溶液在氯化氢的气流中蒸发、结晶、过滤 | 制备氯化镁晶体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“氢能”是未来最理想的新能源。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为_____。(填序号)
A.2H2(g)+O2(g)=2H2O(l) ΔH =-142.9 kJ·mol1
B.H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol1
C.2H2+O2=2H2O(l) ΔH= 571.6 kJ·mol1
D.H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ·mol1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
① CaBr2+H2O![]() CaO+2HBr
CaO+2HBr
② 2HBr+Hg![]() HgBr2+H2↑
HgBr2+H2↑
③ HgBr2+_______![]() ________
________
④ 2HgO![]() 2Hg+O2↑
2Hg+O2↑
⑤2H2+O2![]() 2H2O
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式:___________。并根据“绿色化学”的思想评估该方法制H2的主要缺点_________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。如图是其中的一种流程,其中用了过量的碘。
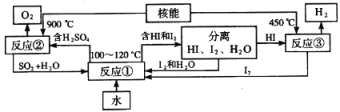
完成下列反应的化学方程式:反应①______________;反应②____________。此法制取氢气的最大优点是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是一氧化碳和氢气的混合气,它由煤炭与水(蒸气)反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式___________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2 220.0 kJmol1。已知CO气体燃烧的热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJmol1。试比较相同物质的量的C3H8和CO燃烧,产生的热量比值约为_________。
(3)已知氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol1。试比较同质量的氢气和丙烷燃烧,产生的热量比值约为______。
(4)氢气是未来的能源,除产生的热量大之外,还具有的优点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ·mol-1 B. -43.5 kJ·mol-1 C. +43.5 kJ·mol-1 D. +67.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
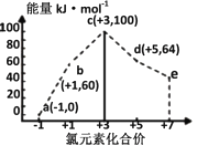
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com