
【题目】短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为31。则下列判断正确的是

A.R位于元素周期表中第二周期第ⅣA族
B.原子半径:X<R<T
C.最简单气态氢化物稳定性:T>R>Y
D.最高价氧化物对应的水化物酸性:T>R>Y
【答案】C
【解析】
试题五种元素属于短周期元素,设R的最外层电子数为a,则T的最外层电子数a+1,X的为a-1,Y的为a,Z的为a+1,最外层电子数之和为31,即a+a+1+a-1+a+a+1=31,解得a=6,推出R:O,T:F,X:P,Y:S,Z:Cl,A、R位于第二周期ⅥA族元素,故错误;B、原子半径大小比较规律:看电子层数:电子层数越大,半径越大,电子层数相同,看原子序数:原子序数越大,半径越小,原子半径大小顺序:P>O>F,故错误;C、氢化物的稳定性,与非金属性强弱有关,非金属性越强,其氢化物越稳定,非金属性强弱:F>O>S,氢化物的稳定性:HF>H2O>H2S,故正确;D、非金属性越强,其最高价氧化物对应的水化物酸性越强,F非金属性强,没有正价,O在中学阶段没有正价,故错误。


科目:高中化学 来源: 题型:
【题目】科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电,电池负极反应为( )
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2-2e-=2H+
D.O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下废液中NH4+能转化为N2(g)和H2O(l),示意图如下:
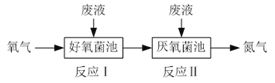
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH1=a kJ·mol-1
反应II:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是
A. 两池发生的反应中氮元素只被氧化
B. 两池中投放的废液体积相等时NH4+能完全转化为N2
C. 常温常压下,反应II中生成22.4 L N2转移的电子数为3.75×6.02×1023
D. 4NH4+(aq)+3O2(g)=2N2(g)+4H+(aq)+6H2O(l) ΔH=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
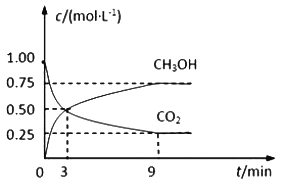
(1)从3 min到9 min,υ(H2)=________mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为______________。
(4)平衡时混合气体中CH3OH(g)的体积分数是__________________。
(5)一定温度下,第9分钟时υ逆(CH3OH) _______(填“大于”、“小于”或“等于”)第3分钟时υ正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯是一种优良的有机溶剂,广泛用于硝化纤维清漆中,在人造革、织物及塑料加工过程中用作溶剂,也用于香料工业。某化学兴趣小组在实验室用乙酸和正丁醇制备乙酸正丁酯,有关物质的相关数据及实验装置如下所示:
化合物 | 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 溶解度(g/100 g水) |
冰醋酸 | 60 | 1.045 | 117.9 | 互溶 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
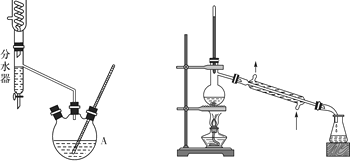
I II
分水器的操作方法:先将分水器装满水(水位与支管口相平),再打开活塞,准确放出一定体积的水。在制备过程中,随着加热回流,蒸发后冷凝下来的有机液体和水在分水器中滞留分层,水并到下层(反应前加入的)水中;有机层从上面溢出,流回反应容器。当水层增至支管口时,停止反应。
乙酸正丁酯合成和提纯步骤为:
第—步:取18.5 mL正丁醇和15.4 mL冰醋酸混合加热发生酯化反应,反应装置如图Ⅰ所示(加热仪器已省略);
第二步:依次用水、饱和Na2CO3溶液、水对烧瓶中的产品洗涤并干燥;
第三步:用装置Ⅱ蒸馏提纯。
请回答有关问题:
(1)第一步装置中除了加正丁醇和冰醋酸外,还需加入___________、______________。
(2)实验中使用分水器的优点有________________、 ___________。根据题中给出的相关数据计算,理论上,应该从分水器中放出来的水的体积约为___________。
(3)第二步用饱和Na2CO3溶液洗涤的目的是____________________________。
(4)第三步蒸馏产品时,应收集温度在_______________左右的馏分。若实验中得到乙酸正丁酯12.76 g,则乙酸正丁酯的产率为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是21世纪化学发展的主导方向。下列不符合“绿色化学” 的是( )
A. 消除硫酸厂尾气中的SO2:SO2+2NH3+H2O===(NH4)2SO3
B. 消除制硝酸工业尾气中的氮氧化物:NO2+NO+2NaOH===2NaNO2+H2O
C. 制CuSO4:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制CuSO4:2Cu+O2![]() 2CuO,CuO+H2SO4(稀)===CuSO4+H2O
2CuO,CuO+H2SO4(稀)===CuSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、将0.1 gMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
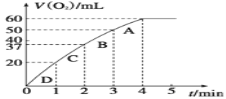
解释反应速率变化的原因:____________________________;计算H2O2的初始物质的量浓度为_________。(保留两位有效数字)
Ⅱ、苯和甲烷是两类烃的代表物质,回答下列问题:
(1) 常温常压下,气态直链烷烃含碳原子数≤_________ 。
(2) 苯和甲烷中含碳量较高的是__________。
(3) 若将等物质的量的苯和甲烷分别燃烧,耗氧量较大的是________________。
(4)写出苯与溴单质反应的化学方程式 __________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的Cu、Cu2O、CuO的固体混合物,将其分成两等份。其中一份通入足量的氢气充分反应后固体质量为25.6g,另一份加入500mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48L。已知Cu2O+2H+=Cu+Cu2++H2O。则稀硝酸的浓度为
A. 4mo1·L-1 B. 2mo1·L-1 C. 1.6mo1·L-1 D. 0.8mo1·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com