
 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.分析 (1)①已知①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ•mol-1
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
由盖斯定律:2×①-②得Na(s)+Na2O2(s)=2Na2O(s)据此计算;
②求出氧气的物质的量,然后根据反应后氧元素的化合价为-1价来分析;
(2)①原电池中,阴离子移向原电池的负极;
②正极上是水溶液中的H+放电;
③熔盐混合物中KCl有降低熔点的作用;电解该熔盐混合物过程Cl-在阳极放电;
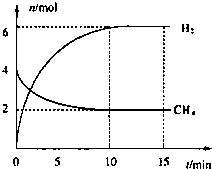
(3)①根据题干和图象所给的信息,可以求出V(CH4),然后根据反应速率之比等于计量数之比来计算;
②a.生成3molH-H键意味着生成3mol氢气,同时有4molC-H键断裂意味着有1mol甲烷消耗;
b.此反应的正反应方向是个气体的物质的量增大的反应;
c.此反应是全部是气体参与和生成的反应;
d.当反应达平衡时,各物质的浓度之间无必然的数值联系;
③根据平衡常数K=$\frac{[CO][{H}_{2}]^{3}}{[C{H}_{4}][{H}_{2}O]}$来计算.
解答 解:(1)①已知①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ•mol-1
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
由盖斯定律:2×①-②得Na(s)+Na2O2(s)=2Na2O(s)△H=2×(-414)-(-511)=-317 kJ•mol-1;
故答案为:-317;
②标况下,5.6L氧气的物质的量n=$\frac{5.6L}{22.4L/mol}$=0.25mol,而反应后氧元素的化合价为-1价,故1mol氧气转移2mol电子,则0.25mol氧气转移0.5mol电子,即3.01×1025或0.5NA个,故答案为:3.01×1025或0.5NA;
(2)①原电池中,阴离子移向原电池的负极,故OH-会向负极移动,故答案为:负;
②正极上是水电离出的H+放电,故正极反应式为:2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
③通过题干可知,熔盐混合物中KCl有降低熔点的作用;电解该熔盐混合物过程Cl-在阳极放电,电极反应式为:2Cl--2e-=Cl2↑,
故答案为:能降低LiC1的熔点;2Cl--2e-=Cl2↑;
(3)①根据题干和图象所给的信息,可知甲烷的反应速率V(CH4)=$\frac{\frac{△n}{V}}{△T}$=$\frac{\frac{2mol}{2L}}{10min}$=0.1mol/(L•min),而反应速率之比等于计量数之比,故V(C)=0.1mol/(L•min),故答案为:0.1mol/(L•min);
②a.生成3molH-H键意味着生成3mol氢气,同时有4molC-H键断裂意味着有1mol甲烷消耗,而消耗1mol甲烷必定生成3mol氢气,与反应是否达平衡无关,故a错误;
b.此反应的正反应方向是个气体的物质的量增大的反应,故在平衡之前,容器的压强会不断增大,现在体系压强不变,则说明平衡,故b正确;
c.此反应是全部是气体参与和生成的反应,故无论反应是否达到平衡,气体的总质量一直不变,故质量不变不能说明反应达平衡,故c错误;
d.当反应达平衡时,各物质的浓度之间无必然的数值联系,故当c(H2O):c(H2)=1:3时,反应不一定平衡,故d错误.
故选b;
③根据题干和图象信息可知:CH4(g)+H2O(g)$\frac{\underline{催化剂}}{△}$CO(g)+3H2(g).
初始C(mol/L):2 3 0 0
转化C(mol/L):1 1 1 3
平衡C(mol/L):1 2 1 3
平衡常数K=$\frac{[CO][{H}_{2}]^{3}}{[C{H}_{4}][{H}_{2}O]}$=$\frac{1×{3}^{3}}{1×2}$=13.5.
故答案为;13.5.
点评 本题综合考查了盖斯定律的应用、电极反应的书写和平衡常数的计算等内容,综合性较强,是高考的热点和难点,题目难度中等.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 13 | B. | 15 | C. | 14 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取1.06g无水Na2CO3,加入100mL容量瓶中溶解,定容 | |
| B. | 需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管 | |
| C. | 定容时俯视容量瓶刻度线,浓度偏高 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
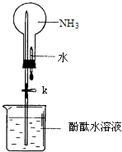 某学习小组欲制取氨气并探究其性质.请回答:
某学习小组欲制取氨气并探究其性质.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 在新生成的AgCl沉淀中滴入稀KI溶液,振荡 | 白色沉淀转化为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4, | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Br- |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热, | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
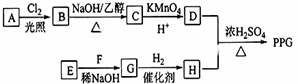

 .
. .
.
 (写结构简式)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是有有c(填标号).
(写结构简式)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是有有c(填标号).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
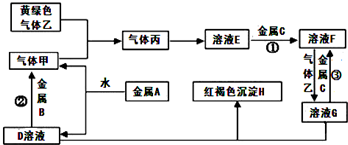 有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com