
下列离子方程式书写正确的是( )
A.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
B.Fe3O4与稀HNO3反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
C.向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH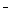 ===CaCO3↓+H2O
===CaCO3↓+H2O
D.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-===CO32-+H2O
科目:高中化学 来源: 题型:
从海水中可以提取溴,主要反应为:2Br-+Cl2===Br2+2Cl-,下列说法正确的是( )
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于复分解反应
D.氯气的氧化性比溴单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:

根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为 。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
(5)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 ,离子浓度最小的离子是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
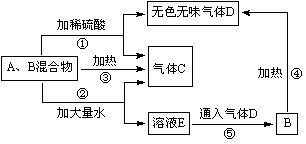
常见化合物A、B,其焰色反应均呈黄色,C是一种单质。转化关系如图所示(其他物质均已略去)。
回答下列问题:
(1)A在通常情况下为淡黄色粉末,常做潜水艇中的供氧剂,写出A的化学式__________。
(2) 写出④的化学方程式______________________________________。
(3) 若溶液E中仅含一种溶质,写出⑤的离子方程式______________________________。
(4) 若A、B混合物在密闭容器中加热,充分反应后,只得到一种固体化合物。则A、B的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种常见元素,且均为短周期元素。已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③ Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧。
(1)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为
。
(2)Z的氧化物在通信领域用来作 ,工业上制Z单质的化学反应方程式为
。
(3)在50mL lmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积最多为 mL。
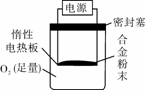
(4)Y、W合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某Y、W合金(设不含其他元素)中W的质量分数,设计下列实验方案进行探究。称量x g Y、W合金粉末,放在如右图所示装置的惰性电热板上,通电使其充分灼烧。欲计算W的质量分数。该实验中还需测定的数据是 。 若用空气代替O2进行实验,对测定结果是否有影响?若有影响分析其原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸氢钠(NaHSO4)通常为晶体,易溶于水。硫酸氢钠溶于水电离出三种不同的离子,溶液显酸性;硫酸氢钠受热熔化后只能电离出两种不同的离子。
(1)硫酸氢钠在水中电离的方程式是_________________________________。
(2)硫酸氢钠在熔融状态下电离的方程式是______________________________。
(3)下列说法中,正确的是________。
A.硫酸氢钠属于酸 B.硫酸氢钠属于盐
C.硫酸氢钠属于电解质 D.硫酸氢钠溶液跟锌单质反应生成氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com