
| A、电负性Y小于X |
| B、X与Y形成化合物时,X显负价,Y显正价 |
| C、最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 |
| D、气态氢化物的稳定性:HmY小于HnX |


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
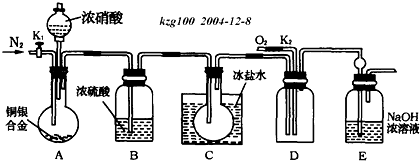
查看答案和解析>>
科目:高中化学 来源: 题型:
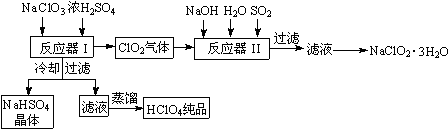
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g按如图所示装置进行实验(铁架台、铁夹等仪器未在图中画出).可供选用的试剂为:浓硫酸、品红溶液、酸性高锰酸钾溶液、碱石灰(可重复使用).
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g按如图所示装置进行实验(铁架台、铁夹等仪器未在图中画出).可供选用的试剂为:浓硫酸、品红溶液、酸性高锰酸钾溶液、碱石灰(可重复使用).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在强碱性溶液中:NH4+、Ag+、NO3-、I- |
| B、在pH=12的溶液中:Na+、K+、AlO2-、CO32- |
| C、在c(H+)=0.1 mol?L-1的溶液中:Ca2+、Fe2+、ClO-、Cl- |
| D、在强酸性溶液中:Mg2+、Al3+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| B、Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C、Ⅰ和Ⅱ中正极均被保护 |
| D、Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为1/22.4 mol/L |
| B、标准状况下,将64g铜片投入到含2 molH2SO4的浓硫酸中加热会产生22.4 L的SO2气体 |
| C、向含1mol碳酸钾的溶液中缓缓滴加含1 mol溶质的稀盐酸会产生1mol CO2气体 |
| D、向含有1mol Ba(OH)2溶液中通入1molCO2气体就会产生1mol Ba(HCO3)2白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com