
分析 在一定条件下:xA+yB?zC的反应达到平衡.
(1)减小压强,平衡向气体体积增大的方向移动;
(2)固体或液体不影响平衡移动;
(3)两种反应物增加一种会提高另一种物质的转化率;
(4)升高温度,平衡向吸热反应方向移动;
(5)若容器容积不变,且A、B、C都是气体,向容器中充入稀有气体,容器中总压增大,气体分压不变,平衡不变.
解答 解:在一定条件下:xA+yB?zC的反应达到平衡,
(1)A、B、C都是气体,减小压强,平衡向气体体积增大的方向移动,则x+y>z,故答案为:x+y>z;
(2)增大固体或液体的量,可逆反应的平衡不移动,B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是固或液态,故答案为:固体或液体;
(3)若容器容积不变,加入气体B,气体A的转化率增大,故答案为:增大;
(4)升高温度平衡向吸热反应方向移动,加热后C的质量分数减少,则平衡向逆反应方向移动,逆反应方向是吸热反应,则正反应是放热反应,故答案为:放热;
(5)若容器容积不变,且A、B、C都是气体,向容器中充入稀有气体,容器中总压增大,气体分压不变,平衡不变,故选C,
故答案为:C.
点评 本题考查了化学平衡的影响因素等知识点,根据外界条件对化学平衡的影响来分析解答,平衡移动原理是解题关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 若水的体积与浓硫酸的体积比为3:1,稀释后溶液的物质的量浓度为4.6mol•L-1 | |
| B. | 若水的体积与浓硫酸的体积比为3:1,稀释后溶液中溶质质量分数为24.5% | |
| C. | 若水的体积与浓硫酸的质量之比为3:1,稀释后溶液的物质的量浓度为4.6mol•L-1 | |
| D. | 若水的质量与浓硫酸的质量比为3:1,稀释后溶液溶质质量分数为24.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片置于硫酸铜溶液中有铜析出 | |
| B. | 铁、铜和氯气反应分别生成FeCl3和CuCl2 | |
| C. | 足量的铁粉和铜粉与浓硫酸反应生成FeSO4和CuSO4 | |
| D. | 铜片置于FeCl3溶液中铜片逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生眼镜反应 | |
| B. | 可用新制Cu(OH)2,鉴别甲酸、乙醛和乙酸 | |
| C. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| D. | 淀粉和纤维素互为同分异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
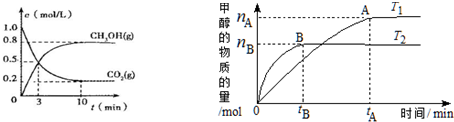
 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子从铜电极沿外电路流向锌电极 | |
| C. | 铅蓄电池的负极为PbO2,属于二次电池 | |
| D. | 锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
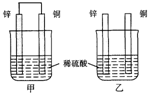
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 甲中铜片是正极,乙中铜片是负极 | |
| C. | 两烧杯中溶液的酸性均减弱 | |
| D. | 甲装置的导线中有电流,电流方向为锌→铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
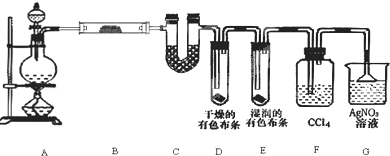
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com