
����Ŀ��25�桢101 kPaʱ��ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ���к���Ϊ57.3 kJ��mol��1�������Ȼ�ѧ����ʽ��д��ȷ����(����)
A. 1/2Ba(OH)2(aq)��1/2H2SO4(aq)![]() 1/2BaSO4(s)��H2O(l)�� ��H����57.3 kJ��mol��1
1/2BaSO4(s)��H2O(l)�� ��H����57.3 kJ��mol��1
B. 1/2KOH(aq)��H2SO4(aq)![]() 1/2K2SO4(aq)��H2O(l) �� ��H����57.3 kJ��mol��1
1/2K2SO4(aq)��H2O(l) �� ��H����57.3 kJ��mol��1
C. 2NaOH(aq)��H2SO4(aq)![]() Na2SO4(aq)��2H2O(l)�� ��H����57.3 kJ��mol��1
Na2SO4(aq)��2H2O(l)�� ��H����57.3 kJ��mol��1
D. KOH(aq)��1/2H2SO4(Ũ)![]() 1/2K2SO4(aq)��H2O(l)�� ��H����57.3 kJ��mol��1
1/2K2SO4(aq)��H2O(l)�� ��H����57.3 kJ��mol��1
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��VIAԪ�ص�����H2��Ӧ������̬H2X���Ȼ�ѧ����ʽ���£�
![]() O2(g) +H2(g) ��H2O(g)
O2(g) +H2(g) ��H2O(g) ![]() H����242kJ��mol��1
H����242kJ��mol��1
S(g)+ H2(g) ��H2S(g) ![]() H����20kJ��mol��1
H����20kJ��mol��1
Se(g)+H2(g)![]() H2Se(g)
H2Se(g) ![]() H��+81kJ��mol��1
H��+81kJ��mol��1
����˵����ȷ����
A. �ȶ��ԣ�H2O< H2S< H2Se
B. ����������Se��H2��Ӧ����H2Se
C. O2(g)+2H2S(g)��2H2O(g)+2S(g) ![]() H����444 kJ��mol��1
H����444 kJ��mol��1
D. ���ź˵���������ӣ�VIA��Ԫ�ص�����H2�Ļ��Ϸ�ӦԽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����������������
A. 22.4L O2(��״��) B. 1.6 g H2
C. 1.2 mol H2SO4 D. 28g CaO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ����
A. ��״���£�11.2L�ȷ��к���C-Cl������ĿΪ1.5NA
B. 2.8g��ϩ��2.8g����ϩ�к�̼ԭ������Ϊ0.2NA
C. 6.8g����̬KHSO4�к���0.1NA��������
D. ���³�ѹ�£�17g����-14CH3��������������Ϊ9NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ�������������ת����˵����ȷ���ǣ� ��
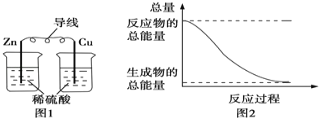
A. ͼ1��ʾ��װ���ܽ���ѧ��ת��Ϊ����
B. ͼ2��ʾ�ķ�ӦΪ���ȷ�Ӧ
C. �кͷ�Ӧ�У���Ӧ��������������������������
D. ��ѧ��Ӧ�������仯����Ҫԭ���ǻ�ѧ���Ķ������γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ͬ״���£�ʹͬһ��ѧ��������Ҫ���յ����������γɸû�ѧ���ų�������������˵����ȷ���ǣ� ��
A. ������ڵ�Al2O3�����Ƶý��������������÷�Ӧ��һ���ų������ķ�Ӧ
B. ���Ϸ�Ӧһ���Ƿ��ȷ�Ӧ
C. ��ͬ״���£���Ӧ2SO2+O2��2SO3��һ�����ȷ�Ӧ����Ӧ2SO3��2SO2+O2һ����һ�����ȷ�Ӧ
D. �ֽⷴӦһ�������ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ��Һ̬������N2H4���м��������������Ӧ��N2H4(l)=N2(g)+2H2(g) ��H��
��֪�� ��3N2H4(l)=4NH3(g)+ N2(g) ��H1=-336.6kJ��mol��1
��N2(g)+3H2(g) ![]() 2NH3(g)��H2=-92.4kJ��mol��1��
2NH3(g)��H2=-92.4kJ��mol��1��
����˵���������
A. ʹ�ô�����Ӧ�ڵ������淴Ӧ�Ļ�ܶ���С������H1����
B. ��H=-151.8kJ��mol��1
C. ��28g N2��10mol H2��ϳ�ַ�Ӧ���ų�������һ��С��92.4 kJ
D. ������Ϊ���ȼ����һ�������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ��Ӧ���ʵ���������ȷ���ǣ� ��
A.ʳ����ڱ����л�������ʵ�����
B.ʵ�����Ʊ�CO2ʱ����ͨ�������¶����ӿ췴Ӧ����
C.ʵ��������Ƭ��ϡ�����Ʊ�H2ʱ��ѡ��98%H2SO4�ܼӿ췴Ӧ����
D.��ѧ��Ӧ�����������о�������һ��ʱ���ڿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200ml��Mg2+��Al3+��NH4+��H+��Cl������Һ�У���μ���5mol/L��NaOH��Һ������NaOH��Һ�������mL����������������ʵ�����mol����ϵ��ͼ��ʾ��������������ȷ����

A. x��y=0.01mol B. ԭ��Һ��c(Cl��)=0.75mol��L��1
C. ԭ��Һ��pH=1 D. ԭ��Һ��n(Mg2+)��n(Al3+)=5:1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com