
| A. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| B. | 定容摇匀后发现液面下降,不应再加蒸馏水 | |
| C. | 称量时托盘上要垫上干净的称量纸 | |
| D. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 |
分析 分析操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n偏小或者使V偏大的操作都能够使溶液浓度偏低,反之使溶液浓度偏高,据此解答.
解答 解:A.定容时俯视容量瓶刻度线,导致溶液的体积偏小,溶液浓偏高,故A正确;
B.定容摇匀后发现液面下降,因为部分溶液沾到瓶塞上,属于正确操作,不应再加蒸馏水,故B正确;
C.天平称量腐蚀品时,应放在小烧杯中进行,故C错误;
D.移液时不慎有部分液体溅出,导致部分溶质损失,溶质的物质的量偏小,溶液浓度偏低,故D正确;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理依据=$\frac{n}{V}$进行误差分析即可解答,注意托盘天平的正确使用方法.


科目:高中化学 来源: 题型:解答题
 现有NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).
现有NaHCO3和Na2CO3•xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |||||||||
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,则CH4的燃烧热△H=-890.3 kJ | |||||||||
| C. | H2(g)+Br2(g)═2HBr(g)△H=-72 kJ•mol-1其他相关数据如表:
| |||||||||
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |

| A. | B F | B. | A E | C. | B E | D. | A D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b时:c(OH-)=c(H+)+c(HS-) | |
| B. | a=2b时:C(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) | |
| C. | a=2.5b时:C(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) | |
| D. | 若4c(Na+)=5c(S2-)+5c(HS-)+5c(H2S),a=3b |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温下,等物质的量浓度的A12(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 | |
| B. | 向Na2SiO3溶液中滴人酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失.证明非金属性:C1>Si | |
| C. | 测定等物质的量浓度的Na2CO3和Na2SiO3溶液的pH,确定碳、硅两元素非金属性的强弱 | |
| D. | 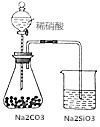 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ca2+)>c(Cl-)>c ( NO3-) | B. | c(Ca2+)>c ( NO3-)>c (Cl-) | ||
| C. | c(NO3-)>c ( Ca2+ )>c ( Cl-) | D. | c ( Cl-)>c(Ca2+)>c(NO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com