
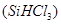 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下: 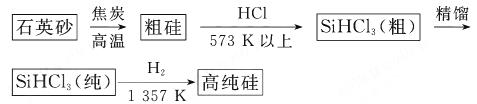
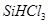 制备高纯硅的化学方程式: 。
制备高纯硅的化学方程式: 。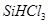 遇水剧烈反应生成
遇水剧烈反应生成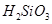 、HCl和另一种物质,配平后的化学反应方程式为? ;
、HCl和另一种物质,配平后的化学反应方程式为? ;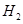 还原
还原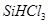 过程中若混入
过程中若混入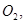 可能引起的后果是? 。
可能引起的后果是? 。| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
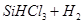
 Si+3HCl
Si+3HCl 

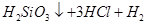 ↑ 发生爆炸 (2)BC
↑ 发生爆炸 (2)BC  ,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。
,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:填空题
| A.石英与普通玻璃都是硅酸盐制品 |
| B.二氧化硅是良好的半导体材料 |
| C.工艺师用盐酸刻蚀石英制作艺术品 |
| D.石英与二氧化碳中的化学键相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。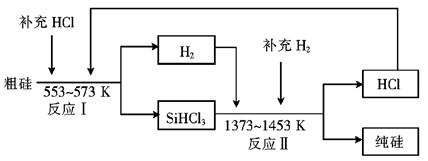
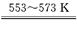 SiHCl3+H2,
SiHCl3+H2,查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石英可用来制作工艺品 | B.硅单质可用来制造太阳能电池 |
| C.硅单质是制造玻璃的主要原料 | D.二氧化硅是制造光导纤维的材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiC是一种新型无机非金属材料,任何条件下都不可能在空气中燃烧 |
B.制造粗硅时的反应:2SiO2+5C Si+SiC+4CO↑ Si+SiC+4CO↑ |
| C.Si、SiO2能用NaOH溶液分离 |
| D.纯净的SiO2只能用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2溶于水形成碳酸,SiO2难溶于水 |
| B.CO2通入可溶性硅酸盐中析出硅酸沉淀 |
| C.高温下SiO2与碳酸盐反应生成CO2 |
| D.氯化氢通入碳酸钠溶液中放出气体,通入硅酸钠溶液中生成沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石英广泛应用于光纤通讯 |
| B.工艺师用盐酸雕刻石英制作艺术品 |
| C.水晶项链和瓷器都是硅酸盐制品 |
| D.粗硅制高纯硅不涉及氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com