
分子中含有10个氢原子的烷烃的分子式是 ;这种烷烃具有 种不同的结构;写出其中没有支链的烃的结构简式 ,
写出该物质与氯气反应生成一氯代物且氯原子在一端碳原子上的化学方程式并注明反应的类型:_____________________________________________________________________。
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 有关性质或结构信息 | 能形成+7价的化合物 | 基态原子核外s能级上的电子数是p能级上的电子数的2倍 | 该元素形成的单质通常有两种同素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 | 通常情况下能形成短周期中最稳定的双原分子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:013
两个原硅酸分子的氢氧原子团之间可以相互作用脱去1分子水,如:![]() .已知原硅酸的结构式为
.已知原硅酸的结构式为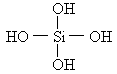 ,则在所得的
,则在所得的![]() 分子中含有的硅氧键数目为
分子中含有的硅氧键数目为
[ ]
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市西城区高三二模试卷(理综)化学部分 题型:填空题
A、B、D、E、Y为5种短周期元素。
①A、B、D位于同一周期,D、Y位于同一主族。A的原子的最外层电子数是其次外层电子数的2倍。
②D的氢化物是最常用的溶剂,E的单质是一种生活中常见的金属。
请回答:
(1)AD2中具有的化学键的类型是 。
(2)高温时,6 gA的单质与D的气态氢化物反应,生成两种还原性气体,吸收的热量为65.75 kJ,其反应的热化学方程式是 。
(3)D与氢元素可组成含有10个电子的X一,与X一组成元素相同,原予数个数比也相同的分子的电子式是 。
(4)将盛有一定量红棕色气体BD2的4L容器压缩至2L,待气体颜色不再变化时,容器内的压强(填“大于”、“等于”或“小于”) 原来的2倍,原因是 。
(5)E的某种化合物可用作净水时的混凝剂,其原理是(用离子方程式表示) 。
(6)YD2气体通入足量BaCl2和B的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一下学期期中考试理科化学试卷(解析版) 题型:填空题
(10分)用“√”或“×”判断下列说法是否正确。
(1)一个D2O分子所含的中子数为8。
(2)HI、HBr、HCl、HF的稳定性依次增强。
(3)同主族元素从上到下,单质的熔点逐渐降低。
(4)常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
(5)从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
(6)将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
(7)在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
(8)二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
(9)用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
(10)苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
【解析】氘原子含有1个中子,所以一个D2O分子中含有10个中子。非金属性是F>Cl>Br>I,所以相应氢化物的稳定性逐渐减弱。同主族元素从上到下,单质的熔点可以逐渐降低,例如第IA,也可以逐渐升高,例如第 ⅦA。在加热是钠和氧气的生成物是过氧化钠。断开化学键要吸热,形成化学键要放热。在原电池中,电子从负极经导线传递到正极上,溶液中的阳离子向正极移动。增大反应物浓度,可以加快反应速率。若甲烷是平面型结构,则二氯甲烷必然存在2种同分异构体。乙烯能使酸性高锰酸钾溶液褪色,甲烷不可以。同时乙烯中含碳量高,燃烧会冒出黑烟。由于苯中不存在碳碳双键,所以不能使溴水褪色,也不能使酸性高锰酸钾溶液褪色。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(10分)用“√”或“×”判断下列说法是否正确。
(1)一个D2O分子所含的中子数为8。
(2)HI、HBr、HCl、HF的稳定性依次增强。
(3)同主族元素从上到下,单质的熔点逐渐降低。
(4)常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
(5)从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
(6)将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
(7)在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
(8)二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
(9)用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
(10)苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
【解析】氘原子含有1个中子,所以一个D2O分子中含有10个中子。非金属性是F>Cl>Br>I,所以相应氢化物的稳定性逐渐减弱。同主族元素从上到下,单质的熔点可以逐渐降低,例如第IA,也可以逐渐升高,例如第 ⅦA。在加热是钠和氧气的生成物是过氧化钠。断开化学键要吸热,形成化学键要放热。在原电池中,电子从负极经导线传递到正极上,溶液中的阳离子向正极移动。增大反应物浓度,可以加快反应速率。若甲烷是平面型结构,则二氯甲烷必然存在2种同分异构体。乙烯能使酸性高锰酸钾溶液褪色,甲烷不可以。同时乙烯中含碳量高,燃烧会冒出黑烟。由于苯中不存在碳碳双键,所以不能使溴水褪色,也不能使酸性高锰酸钾溶液褪色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com