乙醇是一种可燃性液体,按一定比例混合的乙醇汽油是一种新型清洁车用燃料,某科研机构研究利用CO
2合成乙醇的方法:
(Ⅰ)2CO
2(g)+6H
2(g)?CH
3CH
2OH(g)+3H
2O(g)△H
1原料气氢气
(Ⅱ)CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H
2回答下列问题:
(1)使用乙醇汽油(汽油用戊烷代替)燃料时.气缸工作时进行的反应较多,写出燃烧产生有毒气体CO、NO的所有反应的化学方程式:
.
(2)反应(i)中能够提高氢气转化率的措施有
.
a.增大压强 b.加催化剂
c.增大CO
2的浓度 d.及时分离体系中的乙醇
(3)利用CO合成乙醇是目前工业生产较为成熟的工艺.已知下列热化学方程式:
(Ⅲ)CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H
3写出以CO(g)与H
2(g)为原料合成乙醇的热化学方程式:
(焓变用△H
1、△H
3表示).
(4)反应(Ⅱ)中的甲烷和水蒸气是在特定的催化剂表面上进行的,该反应在不同温度下的化学平衡常数如下表:
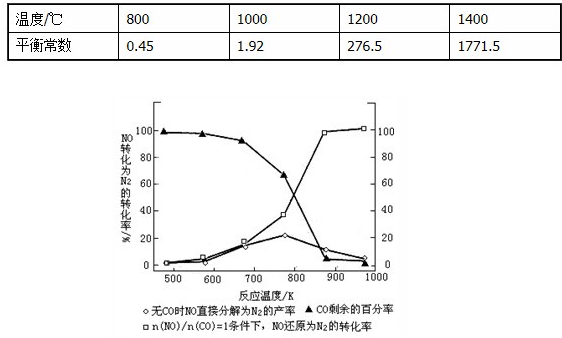
由此推知反应(Ⅱ)的焓变△H
2
0(填“>”、“=”或“<”).某温度下,向容积为1L的密闭容器中加入1mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH
4的浓度变为0.5mol?L
-1.该温度下,反应(Ⅱ)的平衡常数K=
,反应开始至达到平衡时氢气的反应速率v(H
2)=
.
(5)机动车在改用乙醇汽油后,并不能减少氮氧化物的排放.使用合适的催化剂可使NO转化为氮气,实验测得NO转化为氮气的转化率随温度变化曲线如图所示,由图象可知,在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是
;在NO和CO物质的量之比为1:1的情况下,应控制的最佳温度为
左右.




 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g铜片和含0.2mol溶质的18.4mol?L-1浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g铜片和含0.2mol溶质的18.4mol?L-1浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
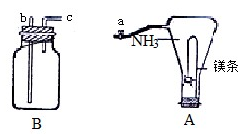 全属镁具有很强的还原性,点燃的镁条能在氨气中剧烈燃烧,发生如下反应:
全属镁具有很强的还原性,点燃的镁条能在氨气中剧烈燃烧,发生如下反应: 短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大.C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大.C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物.
 检验甲基橙试液中是否混有微量酚酞:按如图所示上升纸上层析法实验
检验甲基橙试液中是否混有微量酚酞:按如图所示上升纸上层析法实验