
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
【答案】B
【解析】
A.未达到平衡状态,气体的密度也一直不变;
B.该反应进行到第3分钟时向正反应方向进行;
C.根据v=△c/△t计算;
D.根据压强之比等于物质的量之比计算。
A.容器内气体密度不再发生变化,容器容积不变,气体的总质量不变,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故A错误;
B.根据表中数据可知反应进行到第3分钟时没有达到平衡状态,反应向正反应方向进行,则逆反应速率小于正反应速率,故B正确;
C.由表格数据可知,4min时达到平衡,消耗二氧化硫为0.20mol-0.08mol=0.12mol,即生成SO3为0.12mol,浓度是0.06mol/L,则用SO3表示的平均反应速率为0.06mol/L÷4min=0.015 mol/(Lmin),故C错误;
D.开始SO2和O2的物质的量分别为0.2mol、0.1mol,由表格数据可知平衡时SO2、O2、SO3的物质的量分别为0.08mol、0.04mol、0.12mol,由压强之比等于物质的量之比可知,达到平衡状态时的压强与起始时的压强之比为(0.08+0.04+0.12)/(0.2+0.1)=4:5,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是
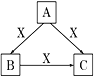
A. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
B. 若X为KOH溶液,则A可能为Al
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为Fe,则C可能为Fe(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向2L密闭容器中加入2molX、1molY。发生如下反应:2X(g)+Y(?) ![]() 3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸工业的副产品氟硅酸(H2SiF6)溶液中含少量碘,其回收方案如下。
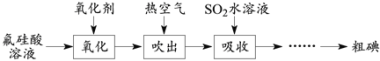
已知:①氟硅酸溶液中碘的可能存在形式为I2、I-、I3-;② I2 + I-![]() I3-。
I3-。
(1)K2Cr2O7、H2O2、NaClO和NaNO2都能使I-氧化为I2。NaNO2在氧化I-时会产生NO,该反应的离子方程式为____。从减少对环境污染的角度,上述氧化剂中可选用的有H2O2、____。
(2)生成的I2可用热空气吹出的原因是____。
(3)在吸收时采用气-液逆流接触,则从吸收装置底部通入的是____(填“吸收液”或“含碘空气”)。吸收后的溶液需反复多次循环吸收含碘空气,其作用是:①提高SO2的利用率;②____。
(4)请补充完整证明氟硅酸溶液中存在I![]() 的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。
的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙、丁、戊五种短周期元素,原子序数依次增大,其常见化合价依次为+1、-2、+1、+3、-1。它们形成的物质间的转化关系如下图所示。常温下用惰性电极电解(有阳离子交换膜)1L l mol/L的A溶液。
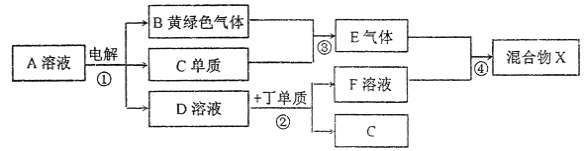
请按要求回答下列问题:
(1)己元素与丙元素同主族,比丙原子多2个电子层,则己的原予序数为______;推测相同条件下丙、己单质分别与水反应剧烈程度的依据是_________。
(2)甲、乙、戊按原予个数比1:1:1形成的化合物Y具有漂白性,其电子式为______。
(3)上图转化关系中不属于氧化还原反应的有(填编号)______。
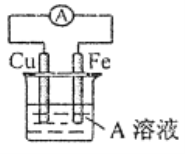
(4)接通如图电路片刻后,向烧杯中滴加一种试剂即可检验铁电极被腐蚀,此反应的离子方程式为___________。
(5)写出反应③的化学方程式_________;反应②的离子方程式为___________。
(6)若上图中各步反应均为恰好完全转化,则混合物X中含有的物质(除水外)有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图,则下列说法正确的是( )
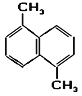
A. 该物质为苯的同系物
B. 该物质的官能团是苯环
C. 该物质能使酸性高锰酸钾褪色
D. 在铁做催化剂时,该物质可以和溴水发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为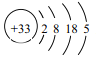 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。
(2)N元素非金属性比As强,下列说法正确的是___________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
(3)根据下图写出As2O5分解为As2O3的热化学方程式______________________________________。
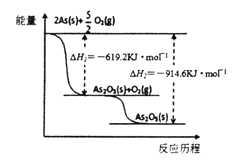
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________。
③写出过程Ⅲ的离子方程式_________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO及H2S都是有毒气体。下列有关这三种气体的说法正确的是 ( )
A. 都能与氧气反应 B. 都易溶于水
C. 都能与碱溶液反应 D. 都是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com