
分析 根据n=$\frac{N}{{N}_{A}}$计算中子物质的量,${\;}_{3}^{7}$Li的中子数为7-3=4,进而计算Li的物质的量,再根据m=nM计算;进行过量计算,根据不足量的物质计算生成D2O的质量;
D2O分子中含有质子数为10,含有中子数为10,质子、中子物质的量为D2O的10倍,据此计算.
解答 解:6.02×1023个中子的物质的量=$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,${\;}_{3}^{7}$Li的中子数为7-3=4,故${\;}_{3}^{7}$Li的物质的量为$\frac{1mol}{4}$=0.25mol,${\;}_{3}^{7}$Li的质量=0.25mol×7g/mol=$\frac{7}{4}$g,
2D2+18O2=2 D218O
4g 36g 44g
故氧气不足,根据根据氧气计算生成D2O的质量=20g×$\frac{44g}{36g}$=24.4g;
故答案为:$\frac{7}{4}$;24.4g.
点评 本题考查物质的量的有关计算,比较基础,侧重基础知识的考查与构成原子微粒关系计,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 由C(s,石墨)═C(s,金钢石)△H>0可知,金刚石比石墨稳定 | |
| B. | CO(g)燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)△H=+566.0kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2+2H2O(I)△H<0,该反应的化学能可以转化为电能 | |
| D. | 已知C(s)+O2(g)═CO2(g)△H1,C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2,则)△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨、液氯、干冰、碘化银均为化合物 | |
| B. | 明矾、小苏打、醋酸、次氯酸均为电解质 | |
| C. | 碘酒、牛奶、豆浆、漂白粉均为胶体 | |
| D. | Na2O2、Na2CO3、Na2SiO3、KNO3均为盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1 的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
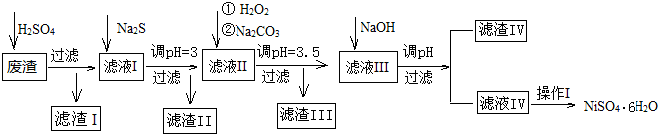
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.
A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R)表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液 | B. | NH4HCO3溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
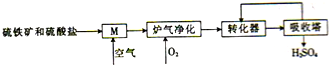 煤是重要的化工原料,煤的脱硫可减少环境的污染,利用煤矸石中的硫铁矿(主要成分为FeS2)和烟道脱硫得到的硫酸盐生产硫酸的工艺流程如图所示.
煤是重要的化工原料,煤的脱硫可减少环境的污染,利用煤矸石中的硫铁矿(主要成分为FeS2)和烟道脱硫得到的硫酸盐生产硫酸的工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH-)=1×10-amol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | 常温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com