
| A. | 苯甲酸共有四个同分异构体(含苯环且包括苯甲酸) | |
| B. | 相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷 | |
| C. | CH3COOCH3在核磁共振氢谱中有两种不同类型的氢原子 | |
| D. | 两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物 |
分析 A.苯甲酸的同分异构体可以是酯,也可以是酚醛;
B.烷烃的相对分子质量越大,沸点越高;碳原子数越多,羟基数越多,沸点越高;相同碳原子的醇的沸点大于烷烃;
C.根据等效氢原子法判断分子中所含的不同氢原子的种类;
D.两种不同的氨基酸在缩聚反应时,可以是同种分子间,也可以是不同分子间,不同分子间至少有2种产物;
解答 解:A.苯甲酸的同分异构体可以甲酸苯酚酯,也可以是酚醛,羟基分别在醛基的邻位、间位、对位,有三种结构,苯甲酸共有五个同分异构体(含苯环且包括苯甲酸),故A错误;
B.烷烃的相对分子质量越大,沸点越高,则沸点:乙烷>甲烷;碳原子数越多,羟基数越多,沸点越高,则沸点:乙二醇>乙醇;相同碳原子的醇的沸点大于烷烃,所以沸点:乙二醇>乙醇>乙烷>甲烷,故B正确;
C.CH3COOCH3 有2种不同环境下的氢原子,故C正确;
D.两种不同的氨基酸在缩聚反应时,可以是同种分子间,有2种聚合物,也可以是不同分子间,不同分子间至少有2种产物,所以生成物不少于4种,故D正确;
故选A.
点评 本题主要考查了有机物结构与性质,难度不大,把握有机物的性质为解答的关键,注意规律性知识的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 阳离子 | K+Na+Cu2+Al3+ |
| 阴离子 | SO42- HCO3-NO3-OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
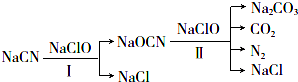
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
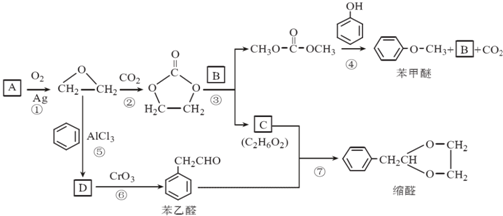
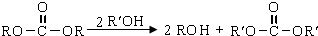
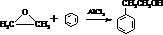 .
.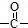 结构的苯乙醛的所有同分异构体的结构简式:
结构的苯乙醛的所有同分异构体的结构简式: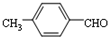 、
、 .
.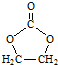 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备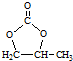 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)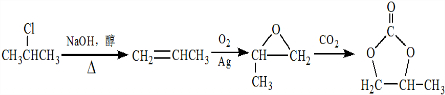 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:
绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 、加入氯化铁的目的是加深溶液颜色,放大实验现象 | |
| B. | 、本实验的目的是研究浓度对双氧水分解速率的影响 | |
| C. | 、本实验过程中A、B试管都不明显,可以将那个很不明显的试管放入热水浴中来观察 | |
| D. | 、小明刚把A药品准备好,就有事情出去了,第二天继续这个实验来进行比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=10的浓氨水稀释,溶液中所有离子的浓度都减小 | |
| B. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合液中,c(H+)<c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com