
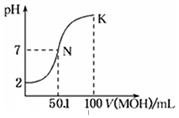
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )| A. | HA的电离方程式为:HA=H++A- | |
| B. | MOH为一元弱碱 | |
| C. | K点对应的溶液中有:c(MOH)+c(M+)=0.02mol•L-1 | |
| D. | N点对应的溶液中有:c(M+)=c(A-) |
分析 0.01mol•L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,根据K点的物料守恒和电荷守恒来分析.
解答 解:A、0.01mol•L-1 HA溶液中pH=2,则HA是强酸,故HA的电离方程式为:HA=H++A-,故A正确;
B、N点时加入的MOH溶液体积为50.1mL,此时溶液呈中性,故MOH为弱碱,故B正确;
C、在K点时,加入的MOH溶液的体积为100mL,所得溶液为浓度均为0.005mol/L的MA和MOH的混合液,根据物料守恒可知,c(MOH)+c(M+)=0.01mol•L-1,故C错误;
D、在N点时,根据溶液的电中性可知:c(M+)+c(H+)=c(OH-)+c(A-),而N点溶液又显中性,故有:c(H+)=c(OH-),则可知:c(M+)=c(A-),故D正确.
故选C.
点评 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:实验题
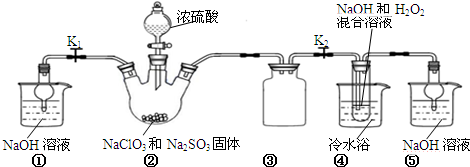
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 0.125mol | C. | 0.1mol | D. | 0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL | B. | 600mL | C. | 800mL | D. | 1000mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与水蒸气反应的产物是黑色的Fe2O3 | |
| B. | 红热的铁能与水蒸气反应,放出的气体点燃时能发出爆鸣声 | |
| C. | 铁与水蒸气的反应是氧化还原反应 | |
| D. | 常温下,Fe与H2O不反应,但在空气中的O2、H2O共同作用下能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
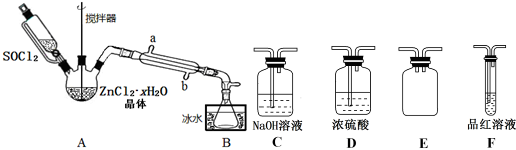
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | CO2和CH4 | C. | NaCl和HCl | D. | CCl4和H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com