
【题目】2008年,三鹿等多家乳制品企业为使蛋白质含量检测合格而加入三聚氰胺,使多名儿童患肾结石,实验室可用下列实验装置测定三聚氰胺的分子式。
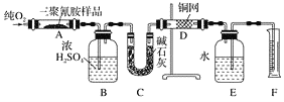
已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成二氧化碳、水、氮气,实验测得装置B增重0.54g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是_____。
(2)需要加热的装置是____(填字母代号)。
(3)装置D的作用是_____。
(4)F处读数时应该注意的是____、_____。
(5)三聚氰胺的分子式为____。
【答案】用来排水,以测定氮气的体积 AD 吸收未反应的氧气 量筒内的液面与广口瓶内的液面相平 视线与凹液面最低处相切 C3N6H6
【解析】
三聚氰胺在氧气中燃烧,生成的水被B中的浓硫酸吸收,生成的二氧化碳被C中的碱石灰吸收,过量的氧气被D中的铜网吸收,生成的N2进入E中,把E中的水排入F中。通过测定生成的水、二氧化碳和氮气的量,就可以确定三聚氰胺的最简式,再根据三聚氰胺的相对分子质量,就可以确定其分子式。
(1)E装置的作用是用来排水,以测定氮气的体积。
(2)三聚氰胺燃烧,需要加热硬质玻璃管A,吸收氧气要通过灼热的铜网,所以D也需要加热,所以需要加热的装置是AD。
(3)装置D的作用是吸收未反应的氧气,以防干扰氮气体积的测定。
(4)F处读数时,应该使量筒内的液面与广口瓶内的液面相平以保证压强一定,同时还要注意视线与凹液面最低处相切。
(5)装置B增重0.54g,即生成水0.54g,即0.03molH2O;C增重1.32g,即生成CO20.03mol;排入F中水的体积即为生成的氮气的体积,为672 mL,即0.03mol,所以三聚氰胺中C、H、N的原子个数比为0.03:0.06:0.06=1:2:2,所以三聚氰胺的最简式为CH2N2,三聚氰胺的相对分子质量为126,所以三聚氰胺的分子式为C3N6H6。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某反应进行过程中,各物质物质的量的变化情况如图所示。下列说法正确的是

A. C、D是生成物
B. 反应的方程式为2A + B![]() 2C
2C
C. 2 min后各物质的量不再变化
D. 该反应不是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。
Ⅰ.某校研究性学习小组设计下图工艺流程以回收铜和硫酸亚铁。请回答:
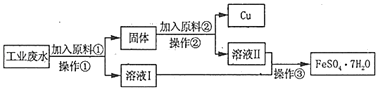
(1)加入原料①反应的离子方程式为_____
(2)操作①中用到的玻璃仪器是_____(填序号)。
a.烧杯 b.漏斗 C.玻璃棒 d.酒精灯
(3)加入原料②的名称为_____
Ⅱ.回收的铜可用于制备胆矾(CuSO45H2O)。将铜和一定浓度稀硫酸混合后在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2═2CuSO4+2H2O,制得硫酸铜溶液后,经过蒸发浓缩冷却结晶、过滤可得胆矾
(1)请分析2Cu+2H2SO4+O2![]() 2CuSO4+2H2O反应中,氧化剂是_____氧化产物是_____(填化学式)
2CuSO4+2H2O反应中,氧化剂是_____氧化产物是_____(填化学式)
(2)用双线桥标出反应中电子转移的方向和数目______________________
(3)若有147gH2SO4参与反应,则反应转移的电子数目为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后产生1.16g白色沉淀,在所得的浊液中逐滴加入1 molL-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示。

请回答下列问题:
(1)B点的沉淀物的化学式为_____
(2)写出混合物溶于水时发生反应的离子方程式_____
(3)原混合物中MgCl2的物质的量为_____
(4)原固体混合物中NaOH的质量为_____
(5)Q点加入HCl溶液的体积为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有H+、Mg2+、Al3+三种阳离子,逐滴加入0.1mol/L NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示,则下列说法正确的是

A.横坐标0—50mL 时,发生反应只有:Mg2++2OH-= Mg(OH)2↓Al3++3OH-= Al (OH)3↓
B.B点生成沉淀的质量为13.6g
C.若往C点的溶液中加入0.1mol/L 盐酸100 mL ,沉淀将全部溶解
D.H+、Mg2+、Al3+三种阳离子物质的量浓度之比为2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在pH约为9时,用澄清石灰水可将水体中的HPO42-化为Ca10(PO4)6(OH)2沉淀除去,该反应的离子方程式为_____________。
(2)除去地下水中的硝态氮通常用还原剂将其还原为N2。
①Prusse等提出的用Pd-Cu作催化剂,常温下,在pH为4.0~6.0时,可直接用H2将NO3-还原为N2,该反应的离子方程式为__________。研究发现用H2和CO2的混合气体代替H2,NO3-的去除效果比只用H2时更好,其原因是________。
②在pH约为5时,用纳米Fe粉可将NO3-还原为N2,Fe粉被氧化为Fe2+,该反应中氧化产物与还原产物的物质的量之比为_________。
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(2NH3+3ClO-=N2+3H2O+3Cl-),pH与氨态氮的去除率关系如图所示,在pH大于9时,pH越大,去除率越小,其原因是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按如图路线合成:

(1)写出由乙烯制取A的化学方程式:____。
(2)乙烯能使溴水和酸性KMnO4溶液褪色,二者褪色原理相同吗?_____。原因是______。
(3)以乙烯为原料,能否制得乙炔?_____。若能,请写出相关的化学方程式_______。
(4)请写出C的含有苯环的同分异构体的结构简式:______。
(5)写出甲苯与浓硝酸和浓硫酸的混合酸反应的化学方程式:_____。
(6)写出C→D的化学方程式:_______,
(7)C能发生消去反应吗?______。原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com