
铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的有关说法中正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.Fe3+与KSCN产生血红色沉淀
科目:高中化学 来源: 题型:
如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是( )
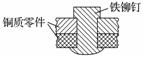
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e===Fe2+
D.发生化学腐蚀:Fe+Cu2+===Cu+Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
关于FeCl3进行的实验,下列预测正确的是( )
| 选项 | 实验 | 预测 |
| A | 蒸发FeCl3溶液 | 得到FeCl3固体 |
| B | 在FeCl3、CuCl2混合液中,加入少量Fe粉 | 一定有H2产生且有Cu析出 |
| C | 用FeCl3固体溶于水配制饱和溶液 | 会有Fe(OH)3沉淀产生 |
| D | 在FeCl3溶液中加入KHCO3溶液 | 有CO2产生,但无Fe(OH)3沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限。
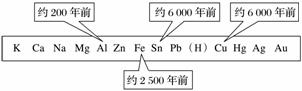
根据上图回答下列问题。
(1)铝是地壳中含量最高的金属元素,为什么人类对铝的使用比铁、铜晚得多?
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO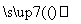 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性______(选填“强”、“弱”)。利用上述方法可制取Ba的主要原因是______。
A.高温时Al的活泼性大于Ba
B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定
D.Ba的沸点比Al的低
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物是中学化学中的一类重要物质,下列关于铁元素的叙述中正确的是( )
A.2Fe3++Fe===3Fe2+成立说明氧化性:Fe3+>Fe2+
B.25 ℃,pH=0的溶液中,Al3+、NH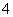 、NO
、NO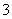 、Fe2+可以大量共存
、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+===Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同回答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。
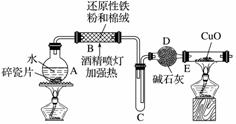
(1)硬质玻璃管B中发生反应的化学方程式为__________________________________。
(2)反应前A中投放碎瓷片的目的是___________________________________________。
(3)装置E中的现象是______________________________________。
探究二 设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于________后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变血红色,推断硬质玻璃管B中固体物质的成分为________(选填序号,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为________。
①一定有Fe3O4 ②一定有Fe
③只有Fe3O4 ④只有Fe
(6)另一份用__________(填仪器名称)加入________(填试剂和现象),可以证明溶液中存在Fe2+。
探究三 设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
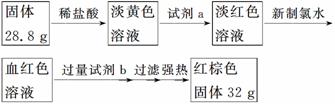
(7)试剂b的化学式是________。
(8)计算反应后B装置中铁元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知植物油的组成元素只有C、H、O三种,某科研机构指出:将植物油代替汽油做汽车的燃料具有战略意义,这项研究已经取得了实质性进展,并已经开始试用,这对于汽油价格居高不下是一个很大的冲击,对消费者来说是一个很好的消息。据以上信息,下列有关植物油代替汽油的说法错误的是
( )。
A.使用植物油代替汽油作燃料有助于减轻大气污染,改善大气环境
B.推广使用植物油代替汽油可在一定程度上缓解当前能源紧张的形势
C.植物油是一种二级能源,与汽油相似,也是一种不可再生能源
D.使用植物油代替汽油有利于调整产业结构、增加农民收入、促进经济发展
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) 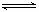 Fe(s)+ CO2(g)已知1100℃,K=0.263
Fe(s)+ CO2(g)已知1100℃,K=0.263
(1) 1100℃时,若平衡向右进行,高炉内CO2和CO的体积比值 。(填“增大”“减小”或“不变”)
(2)1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态 (填“是”或“否”),此时化学反应速率是V正 V逆(填“大于”、“小于”或“等于”),其原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com