
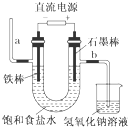
| A. | 装置中,a管能产生氢气 | |
| B. | 在石墨棒电极区域有NaOH产物 | |
| C. | b管导出的是氯气 | |
| D. | 以食盐水为基础原料制取氯气等产品的工业称为“氯碱工业” |
分析 根据图知,Fe作阴极、C作阳极,Fe电极反应式为2H2O+2e-=H2↑+2OH-,C电极反应式为2Cl─-2e-=Cl2↑,则a得到的气体是氢气、b管导出的气体是氯气,则Fe棒附近有NaOH生成;所以该电解池电解过程中有氯气、氢气和NaOH生成,据此分析解答.
解答 解:A.根据图知,Fe作阴极、C作阳极,Fe电极反应式为2H2O+2e-=H2↑+2OH-,C电极反应式为2Cl─-2e-=Cl2↑,则a得到的气体是氢气、b管导出的气体是氯气,故A正确;
B.根据A知,石墨电极附近没有NaOH生成,Fe电极附近有NaOH生成,故B错误;
C.根据A知,b管导出的气体是氯气,故C正确;
D.该电解池电解过程中有氯气、氢气和NaOH生成,所以以食盐水为基础原料制取氯气等产品的工业称为“氯碱工业”,故D正确;
故选B.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,注意:如果将Fe作阳极电解时,阳极上发生的电极反应为Fe-2e-=Fe2+,较活泼金属作阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
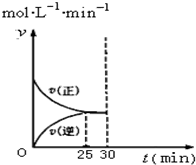 实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:
实验室模拟SO2与O2在一定条件下反应生成SO3.现将1.00mol SO2与1.00mol O2置于一体积不变的1L密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-l.在其他条件不变的情况下,不同温度时SO3的浓度(mol•L-1)随时间(min)的变化如表格所示:  | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| T1 | 0 | 0.20 | 0.30 | 0.39 | 0.47 | 0.50 | 0.50 |
| T2 | 0 | 0.25 | 0.40 | 0.40 | 0.40 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中Cl2是氧化剂,KOH是还原剂 | |
| B. | KCl是还原产物,KClO3是氧化产物 | |
| C. | 反应过程中3个氯分子共转移6个电子 | |
| D. | 被氧化的氯原子是被还原的氯原子的5倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液、CuO、HClO、Cu | |
| B. | 普通玻璃、H2O、FeCl3、葡萄糖 | |
| C. | 水银、Na2O、BaSO4、SO3 | |
| D. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2 H+═CO2↑+H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{催化剂/△}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 葡萄可用于酿酒.
葡萄可用于酿酒. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.| ①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为90: |
| ②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为0.3 mol, 生成的H2O5.4g. 有机物E的分子式C3H6O3 |
| ③经红外光谱测定,证实其中含有羟基,羧基,甲基; | ③E的结构简式CH3CH(OH)COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com