
【题目】某固体混合物X可能是由![]() 、Fe、
、Fe、![]() 、
、![]() 中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)
中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)
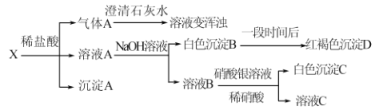
下列说法不正确的是
A.气体A是![]() 、
、![]() 的混合物
的混合物
B.沉淀A是![]()
C.根据白色沉淀C是AgCl可知,白色沉淀B一定不是纯净物
D.该固体混合物一定含有Fe、![]() 、
、![]()
【答案】C
【解析】
根据实验现象逐步分析、推理,并进行验证,确定混合物的组成成分 。
A. 据转化关系图,气体A能使石灰水变学浑浊,则A中有CO2,X中有Na2CO3。白色沉淀B能变成红褐色,则白色沉淀B中有Fe(OH)2,溶液A中有FeCl2,X中有Fe,进而气体A中必有H2,A项正确;
B. X与过量盐酸反应生成沉淀A,则X中含Na2SiO3,沉淀A为H2SiO3,B项正确;
C. 溶液B中加入硝酸银和稀硝酸生成白色沉淀C,则C为AgCl,溶液B中的Cl-可能全来自盐酸,则X中不一定有MgCl2,白色沉淀B中可能只有Fe(OH)2,C项错误;
D. 综上分析,固体混合物X中一定含有Fe、![]() 、
、![]() ,可能有MgCl2,D项正确。
,可能有MgCl2,D项正确。
本题选C。


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合成重要的有机化合物路线如下图所示,请回答下列问题。(已知:A与金属钠可以反应生成无色气体)
![]()
(1)A物质所含官能团的名称是:_______,A与钠反应的化学方程式为_________。
(2)反应③的化学方程式是:________。
(3)下列物质中,不能通过乙烯加成反应得到的是:_______(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(4)葡萄可用于酿酒。检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2悬浊液,加热,其现象是:__。
(5)若D为一种常见的高分子化合物,可以用于制作保鲜膜,则反应①的反应类型为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证与![]() 和
和![]() 的氧化性强弱,下列装置能达到实验目的的是____________________(填序号),写出正极的电极反应式___________________。若构建原电池时两个电极的质量相等,当导线中通过
的氧化性强弱,下列装置能达到实验目的的是____________________(填序号),写出正极的电极反应式___________________。若构建原电池时两个电极的质量相等,当导线中通过![]() 电子时,两个电极的质量差为____________________。
电子时,两个电极的质量差为____________________。

(2)将![]() 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
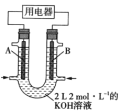
实验测得电池工作时![]() 向B电极定向移动,则____________________(填“A”或“B”)处电极入口通甲烷,其电极反应式为_____________。
向B电极定向移动,则____________________(填“A”或“B”)处电极入口通甲烷,其电极反应式为_____________。
(3)以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。燃料电池的结构如图所示:
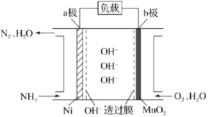
①a极是电池的____________________(填“正”或“负”)极,电极反应式为_______________________。
②当生成![]() 时,电路中通过的电子的物质的量为____________________。
时,电路中通过的电子的物质的量为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某混合物A,含有KAl(SO4)2、Al2O3和Cu2(OH)2CO3,在一定条件下可实现下图所示的物质之间的变化:
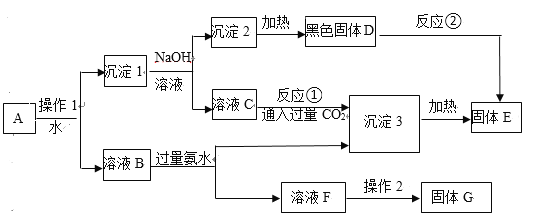
据此判断:
(1)固体G中含有用作化肥的物质,写出其化学式_________。
(2)出土的青铜器上常有铜绿,请写出用稀硫酸除去铜绿的离子方程式_________。
(3)操作1的名称____________; 反应①的离子方程式为____________。
(4)反应②的化学方程式为______________。
II.铝是一种应用广泛的金属,工业上常用冰晶石(Na3AlF6)作助熔剂来冶炼铝。以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
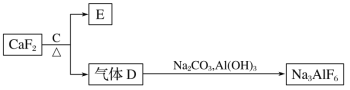
(5)E在医疗上常用作石膏绷带,D的水溶液可用于刻蚀玻璃,C的化学式为_____;并写出由D制备冰晶石的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 NaCl、Na2SO4 和 NaNO3 的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3 晶体,相应的实验流程如图所示。
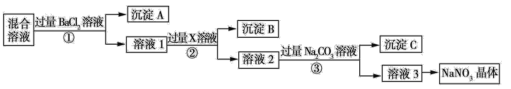
(1)写出实验流程中下列物质的化学式:试剂 X___________,沉淀 A_________。
(2)上述实验流程中①②③步均要进行的实验操作是______________(填操作名称),该过程中玻璃棒的作用是___________。
(3)上述实验流程中加入过量 Na2CO3 溶液的目的是_____________。
(4)按此实验方案得到的溶液3中肯定含有_________________(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的_________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物NOx、SO2和可吸入颗粒物(PM2.5)等会危害人体健康,影响动植物生长,因此应加强对其监测和治理。请回答:
⑴为降低NOx的排放,在汽车尾气系统中装置催化转化器,可将NOx还原成N2排出。写出NO被CO还原的化学方程式:______________。
⑵某研究小组对PM2.5进行监测时,取其样本用蒸馏水处理制成待测试样,测得有关数据如下:
离子 | H+ | Na+ |
|
|
|
浓度(mol/L) | 1×10-5 | 2×10-5 | 3×10-5 | 4×10-5 |
试样中c(H+)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
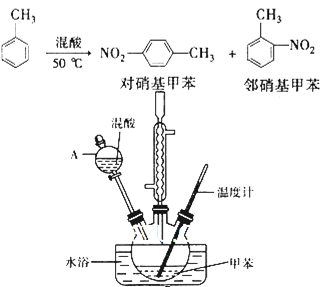
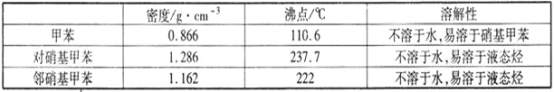
实验中可能用到的数据:
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是________。反应中需不断搅拌,目的是______________
(2)仪器A的名称是________ ,使用该仪器前必须进行的操作是_________。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为________,操作2中需要使用下列仪器中的________(填序号)。
A.冷凝管 B.酒精灯 C.温度计 D.分液漏斗 E.蒸发皿
(5)该实验中一硝基甲苯的产率为________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年7月5日《科学》杂志在线报道:合成一种新的具有超高热导率半导体材料——砷化硼(BAs)。通过反应4BI3(g) + As4(g)![]() 4BAs(s,晶体) + 6I2(g)可制备BAs晶体。下列说法错误的是()
4BAs(s,晶体) + 6I2(g)可制备BAs晶体。下列说法错误的是()
图(a) 图(b) 图(c)
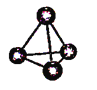
A. 图(a)表示As4结构,As4分子中成键电子对与孤电子对数目之比为3:1
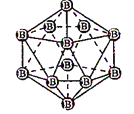
B. 图(b)表示晶态单质硼的B12基本结构单元,该基本单元为正20面体
C. 图(b)所示晶态单质硼的熔点为2180℃,它属于原子晶体
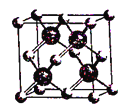
D. 图(c)表示BAs晶胞结构,As原子的配位数为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如下装置制备氯酸钾和次氯酸钠。
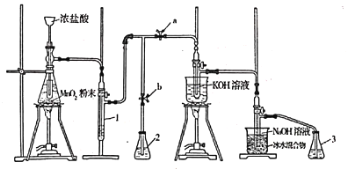
回答下列问题:
(1)滴加浓盐酸的漏斗伸入试管底部,其原因为________________________________。
(2)装置1中盛放的试剂为________;若取消此装置,对实验造成的影响为________。
(3)装置中生成氯酸钾的化学方程式为________________________,产生等物质的量的氯酸钾和次氯酸钠,转移电子的物质的量之比为________。
(4)装置2和3中盛放的试剂均为________。
(5)待生成氯酸钾和次氯酸钠的反应结束后,停止加热。接下来的操作为打开________(填“a”或“b”,下同),关闭________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com