
����Ŀ��ij������ˮ��Һ�п��ܺ������������е������֣�Na+��Al3+��Fe3+��Mg2+��Ba2+��NH4+��Cl����SO42�� �� �ֱַ�ȡ100mL��������Һ��������ʵ�飮 �ٵ�һ�ݼӹ���NaOH��Һ����ȣ��ռ���0.01mol���壬�������ɣ�ͬʱ�õ���Һ�ף�
�������Һ��ͨ�����CO2 �� ���ɰ�ɫ���������������ˡ�ϴ�ӡ����պõ�1.02g���壮
�۵ڶ��ݼ�����BaCl2��Һ�����ɰ�ɫ���������˺�ij�������������ϴ�ӡ�����õ�11.65g���壬����Һ�м���AgNO3��Һ���а�ɫ���������������й�������ȷ���ǣ�������
A.�ɢٿ�֪ԭ��Һ��������ΪNH4+ �� ��Ũ��Ϊ0.01mol/L
B.ԭ��Һһ������Cl��
C.ԭ��Һ�϶�û��Fe3+��Mg2+ �� һ������Na+
D.n��NH4+����n��Al3+����n��SO42����=1��1��5
���𰸡�C
���������⣺������������֪��һ����Al3+��NH4+��SO42����һ������Fe3+��Mg2+��Ba2+���ɵ���غ��֪0.05��2��0.01��1+0.02��3����һ����Na+������ȷ���Ƿ�Cl����
A���ɢٿ�֪ԭ��Һ��������ΪNH4+����Ũ��Ϊ ![]() =0.1mol/L����A����
=0.1mol/L����A����
B������������������ȷ���Ƿ�Cl������B����
C��������������֪��ԭ��Һ�϶�û��Fe3+��Mg2+��һ������Na+����C��ȷ��
D��n��NH4+����n��Al3+����n��SO42����=0.01mol��0.02mol��0.05mol=1��2��5����D����
��ѡC��
�ٵ�һ�ݼӹ���NaOH��Һ����ȣ��ռ���0.01mol���壬�������ɣ�0.01mol����Ϊ��������Һ��һ������NH4+�������ʵ���Ϊ0.01mol��������˵��ԭ��Һ����Fe3+��Mg2+��ͬʱ�õ���Һ�ף�
�������Һ��ͨ�����CO2�����ɰ�ɫ���������������ˡ�ϴ�ӡ����պõ�1.02g���壬˵������Al3+��1.02gΪ��������n��Al3+��= ![]() ��2=0.02mol��
��2=0.02mol��
�۵ڶ��ݼ�����BaCl2��Һ�����ɰ�ɫ���������˺�ij�������������ϴ�ӡ�����õ�11.65g���壬����Ϊ���ᱵ��˵��ԭ��Һ����SO42����һ��������Ba2+��n��SO42����= ![]() =0.05mol������Һ�м���AgNO3��Һ���а�ɫ��������������ȷ����Һ���Ƿ����Cl������ϵ���غ��ж��Ƿ������ӣ��Դ������
=0.05mol������Һ�м���AgNO3��Һ���а�ɫ��������������ȷ����Һ���Ƿ����Cl������ϵ���غ��ж��Ƿ������ӣ��Դ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ȵ�����ˮ�У���ȴ��������кͣ����õ��ij�����( )
A.�Ȼ���
B.��֬������
C.��֬����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������[CO��NH2��2]��Na2CO3������Ҫ�Ļ���ԭ�ϺͲ�Ʒ����ͼ��ij�������������ɰ���������[CO��NH2��2]������IJ��ֹ�������ͼ�� 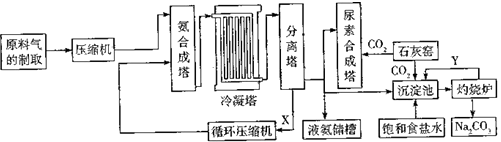
��1��ԭ��������ѹ����ǰ��Ҫ���о�����������Ŀ���� �� �Ʊ����ϳ����IJ�������ܡ����ܡ���ʹ����ͨ��̼�ظ֣�
��2��N2��H2������徭ѹ���������백�ϳ������ŵ��� �� ij����������ѭ��ʹ��ijЩԭ�Ͽ��������Ч�棬��ѭ�����õ������� ��
��3���밴Ҫ����д���пհף�
�ٳ������е����ӷ���ʽ�� ��
���������صĻ�ѧ����ʽ�� ��
��4���ڽϵ��¶��£��ɴӳ����ص���Һ�з����һ�ָ���Ʒ�ɴ˿��ƶϣ�������NH4C1���ܽ�Ⱥܿ������С�ڡ����ڡ���NaCL��NH4C1��һ�ֵ��ʣ�������ʩ����ʹ�����ữ�������ӷ���ʽ��ʾ��ԭ�� ��
��5���Խ�̿��ˮΪԭ���Ʊ�H2 ��̼ת��ΪCO2 �� ��1000g����Ϊa%�������ʲ���ˮ��Ӧ����̿�����Ʊ�g���أ���֪�ϳɰ�ʱh2��������Ϊb%���ϳ�����ʱNH3��������Ϊc%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ����ܼ���������Һ����������Һ����(����)
A.NaOH��Һ
B.ʯ����Һ
C.������Һ
D.Na2CO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ù����M1��һ�־���ǿ�°��Ե��л������ӽṹ��ͼ��ʾ�������йػ���ù����M1��˵����ȷ���ǣ� �� 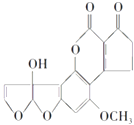
A.����ù����M1�ķ���ʽΪC17H14O7
B.����ù����M1�����ǻ������ǻ��ܱ�������Ϊȩ��
C.1 mol����ù����M1��NaOH��Һ������Ӧ���������2 mol NaOH
D.1 mol����ù����M1�������7 mol H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У������DZ���ԭ�ķ�Ӧ��(����)
A.�����Ƿ���������Ӧ
B.�������������ڱ��CO2��H2O
C.�����DZ�ɼ�����
D.�����DZ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ͳ���������������ͨ���۾��в�ͬ�����ʣ���֪���ڲ�ͬ�¶��£�����������ˮ������Ӧ�Ĺ�����ﲻͬ���¶ȵ���570��ʱ������FeO������570��ʱ������Fe3O4 ��
��1��д���¶ȵ���570��ʱ��Ӧ�Ļ�ѧ����ʽ ��
��2����ѧ�̲�������ͼ��ʾʵ��װ�ã����������ˮ������Ӧ����ʾʵ�飮ʵ����ʹ�÷���Һ�������� ��
��3����ͬѧΪ��̽��ʵ���Ĺ�������Ƿ����Fe3O4���ٶ���ȫ����Ӧ��ȫ���������ʵ�鷽���� ��ȡ������Ʒm1g������������ϡ���
����ٷ�Ӧ�����Һ�м�������H2O2����ҺX�ټӰ�ˮ����ַ�Ӧ���ˡ�ϴ�ӡ����
�۽��������ù���������գ��õ�����ɫ����m2g��
��ҺX�з���������ԭ��Ӧ�����ӷ���ʽΪ��m1��m2������ϵʱ������ȷ��������Ʒ��һ��ֻ����Fe3O4 �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijҩ��H�ĺϳ�·�����£�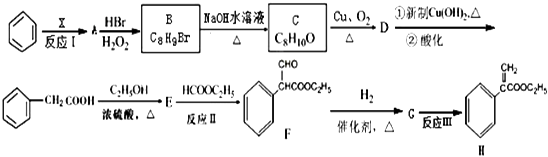
�Իش��������⣺
��1����Ӧ�����漰�����ʾ�Ϊ�������������������ͬ����A������Ϊ �� A�������������̼ԭ����һ��ֱ���ϣ�
��2����ӦI�ķ�Ӧ������ �� ��Ӧ��ķ�Ӧ������ ��
��3��C�Ľṹ��ʽ����E�ķ���ʽΪ��F�к��������ŵ������� ��
��4����B��C��Ӧ�Ļ�ѧ����ʽΪ ��
��5��������G����������ˮ�����֮һM�ж���ͬ���칹�壬ͬʱ�������������Ľṹ���֣�
���ܷ���ˮ�ⷴӦ��������Ӧ��
������FeCl3������ɫ��Ӧ��
�۱�����������ȡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڼ�������ʵ����������������
A. ���ܹ��ڿ�����ȼ��B. ���ܹ���ˮ���ҷ�Ӧ
C. ��������������ɫ��������Դ���ɫ��D. �����Ա�����ú����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com