
【题目】将m克Fe2O3、Al2O3样品溶解在过量的200mL0.1mol·L-1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
A.0.1mol·L-1B.0.2mol·L-1C.0.4mol·L-1D.0.8mol·L-1
【答案】C
【解析】
反应生成硫酸铝、硫酸铁,硫酸可能有剩余,向反应后的混合溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据钠离子守恒有n(NaOH)=2n(Na2SO4),根据硫酸根守恒有n(Na2SO4)=n(H2SO4),据此计算n(NaOH),再根据c=![]() 计算NaOH溶液的浓度。
计算NaOH溶液的浓度。
将a克Al2O3和Fe2O3样品溶解在过量的100ml浓度为0.10mol/L的硫酸溶液中,反应生成硫酸铝、硫酸铁,硫酸可能有剩余,向反应后的混合溶液中加入100mL NaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)=0.2L×0.1mol/L=0.02mol,根据钠离子守恒有:n(NaOH)=2n(Na2SO4)=0.04mol,则该氢氧化钠溶液的浓度为:c(NaOH)=![]() =0.4mol/L。
=0.4mol/L。
答案选C。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
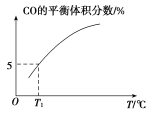
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图是部分短周期元素的常见化合价与原子序数的关系图:
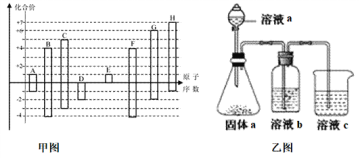
请回答下列问题:
(1)D元素在周期表中的位置为___________,D和G的简单氢化物中沸点高的是___________(写化学式),A和E形成的化合物的电子式为_____________。
(2)D、E、G、H的简单离子半径由大到小的顺序为__________________________。(用化学式表示)
(3)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,常温共产生9mol气体,写出该反应的化学方程式_________________。
(4)由上述元素中的几种组成a、b、c各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。
①溶液a和b分别为________,________(填化学式)。
②溶液c中的离子方程式为__________________________________________。
③请从原子结构的角度解释非金属性C>B的原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)海水淡化的方法有_____(选填一种即可)。
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是____。
(3)下图是从海水中提取镁的简单流程。
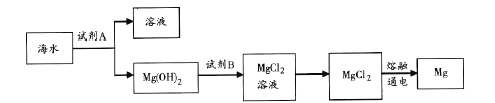
工业上常用于沉淀Mg2+的试剂A 的俗名是___,Mg(OH)2转化为MgCl2 的离子方程式是_______。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2 的途径如下所示:
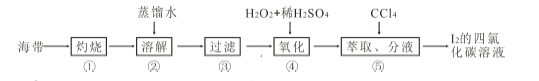
①灼烧海带至灰烬时所用的主要仪器名称是_______。步骤②加热煮沸一会的目的是______________。
② 步骤④向滤液中加H2O2 和稀H2SO4 溶液,写出该反应的离子方程式_______________。反应结束后,再加入CCl4 作萃取剂,振荡、静置,可以观察到CCl4 层呈____________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①2F2+2H2O=4HF+O2↑;②AlCl3+3NaHCO3=Al(OH)3↓+3NaCl+3CO2↑ ;③2Na+2H2O=2NaOH+H2↑;④SO2+H2O=H2SO3⑤SO2+Cl2+2H2O=H2SO4+2HCl;⑥NaH+H2O=NaOH+H2↑;⑦CO+H2O![]() CO2+H2;⑧3NO2+H2O = 2HNO3+NO
CO2+H2;⑧3NO2+H2O = 2HNO3+NO
(1)上述反应中不属于氧化还原反应的有(填序号,下同)_____________
(2)H2O被氧化的是_____________;属于氧化还原反应,但H2O既不被氧化,也不被还原的是_____________。
(3)写出⑤的离子反应方程式_____________。
(4)用双线桥法表示反应⑧中电子转移的方向和数目,并指出氧化产物和还原产物。双线桥法:_____________;氧化产物:_____________;还原产物:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。原混合气体中H2和O2的物质的量之比为( )
A.1:10B.9:1C.4:1D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiIFePO4)电池(如图所示)是新能源汽车的动力电池之一。M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池的总反应为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法正确的是
LiFePO4+6C。下列说法正确的是
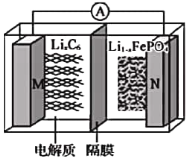
A. 放电时,Li+向M电极移动
B. 充电时电路中每通过0.5mol电子,就有36g碳和金属锂复合在一起
C. 放电时,M电极的电极反应为![]()
D. 充电时,N电极的电极反应为LiFePO4-xe-=xLi++Li1-xFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲化钠(Na2Te)可用作有机合成试剂及缩合反应中的催化剂。以碲铅矿(主要成分为PbTe)和粗盐(含CaCl2、MgCl2及一些硫酸盐、泥沙)为原料制备碲化钠的工艺流程如下:
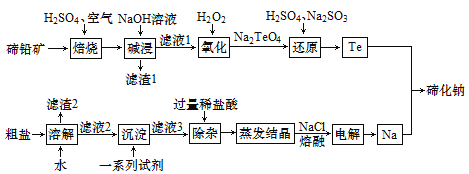
回答下列问题:
(1)Na2TeO4中Te的化合价为___。
(2)“沉淀”步骤中一系列试剂均过量,这些试剂依次包括_____(填化学式)和NaOH。
(3)“蒸发结晶”时用到的主要仪器有铁架台(带铁圈)、酒精灯、坩埚钳、_____等。
(4)已知“焙烧”后,碲主要以TeO2形式存在,“焙烧”反应的化学方程式为____。
(5)依据“氧化”“还原”两步反应可判知Na2TeO4、H2O2和Na2SO4氧化性由强到弱的顺序为___;“还原”步骤中,还原剂与氧化剂的物质的量比为_______。
(6)若制得8.7kg碲化钠,理论上电解产生标准状况下氯气的体积为______升。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com