
| A. | 浓H2SO4(热) | B. | 浓HNO3(常温) | C. | 浓盐酸(热) | D. | 稀HNO3(热) |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙烯的分子式:C2H4 | ||
| C. | 乙酸的结构简式:C2H2O2 | D. | 丙烷分子的球棍模型是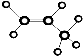 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
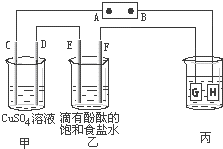 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了让食品保存得更长一些,可以多加一些添加剂 | |
| B. | 在国家卫生部门规定的范围内使用食品添加剂,一般认为对人体无害 | |
| C. | 染衣服的染料也可以用给食品染色 | |
| D. | 某腌制的肉类颜色鲜红,说明该食品既新鲜又安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | NaCl和HCl | ||
| C. | (NH4)2CO3和CO(NH2)2 (尿素) | D. | NaH和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 沉淀X的成分是SiO2、Fe2O3 | |
| B. | 从蛇纹石组成看,其成分皆是碱性氧化物 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 在溶液Y中加入过量的氨水,过滤得到的沉淀是Al(OH)3、Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com