
| A. | 在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 锅炉中沉积的CaSO4可用饱和碳酸钠溶液浸泡,再用盐酸溶解而除去 | |
| C. | 将AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大 |
分析 A.移走NH3,正逆反应速率速率都减小,平衡正向移动;
B.碳酸钙溶解度小于硫酸钙,依据沉淀转化原理解答;
C.AlCl3溶液在加热时水解生成Al(OH)3,Al(OH)3在加热条件下分解生成Al2O3;
D.加热Fe2(SO4)3溶液,Fe3+的水解程度.
解答 解:A.移走NH3,正逆反应速率速率都减小,平衡正向移动,所以提高原料转化率,故A错误;
B.碳酸钙溶解度小于硫酸钙,依据沉淀转化原理可知:锅炉中沉积的CaSO4可用饱和碳酸钠溶液浸泡可以转化为碳酸钙,然后用盐酸除去碳酸钙,故B正确;
C.AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3,故C错误;
D.加热Fe2(SO4)3溶液,Fe3+的水解程度,水解产生氢离子浓度增大,溶液pH值减小,故D错误;
故选:B.
点评 本题为综合题,考查了化学平衡移动理论、沉淀转化原理、盐类水解规律等,熟悉盐类水解的规律及平衡移动原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题

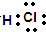 ,其中所含化学键的类型是共价键.
,其中所含化学键的类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| B. | 向试管中滴加液体时,胶头滴管不能伸入试管 | |
| C. | 将FeCl3饱和溶液滴入热的稀氢氧化钠溶液中制备氢氧化铁胶体 | |
| D. | 金属钠着火时,用干燥的沙土覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a与其他元素生成的化合物都是离子化合物 | |
| B. | b与氢形成的所有化合物中化学键均为极性共价键 | |
| C. | c存在两种或两种以上的氧化物 | |
| D. | 在四种元素中,d元素的非金属性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
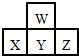 如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是Z>Y>X>W | |
| B. | Z的气态氢化物比X的气态氢化物稳定 | |
| C. | X、Y、Z各元素最高价和最低价的绝对值之和为8 | |
| D. | X、Y、Z最高价氧化物对应水化物的酸性强弱关系Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
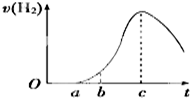 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com