
 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.15 |
| 0.3 |
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
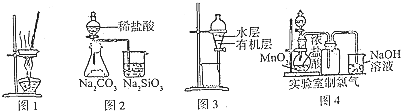
| A、用图l所示装置蒸干AlC13饱和溶液制备AlCl3晶体 |
| B、用图2所示装置证明非金属性Cl>C>Si |
| C、用图3所示装置分离CCl4萃取溴水后已分层的有机层和水层 |
| D、用图4所示装置制取少量Cl2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b | B、a=b |
| C、a<b | D、不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com