
分析 (1)①盐酸是一元强酸完全电离,硫酸是二元强酸完全电离,醋酸是弱酸部分电离;
②盐酸是一元强酸完全电离,硫酸是二元强酸完全电离,醋酸是弱酸部分电离,c(H+)相同时,醋酸浓度最大;
(2)酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,依据KW=c(H+)×c(OH-)计算;
(3)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性,则有c(OH-)=c(H+),结合电荷守恒分析;
(4)明矾溶于水电离出的铝离子发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质,起到净水作用;
(5)FeCl3是强酸弱碱盐,铁离子是弱碱阳离子,将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧Fe(OH)3时,Fe(OH)3会分解生成氧化铁.
解答 解:(1)①盐酸是一元强酸完全电离,氢离子浓度等于酸的浓度;硫酸是二元强酸完全电离,硫酸中氢离子浓度为酸的二倍;醋酸是弱酸部分电离,氢离子的浓度小于酸的浓度;所以c(H+)由大到小的顺序是b>a>c,
故答案为:b>a>c;
②盐酸是一元强酸完全电离,硫酸是二元强酸完全电离,c(H+)相同时,盐酸物质的量浓度是硫酸的2倍,醋酸是弱酸部分电离,c(H+)相同时,醋酸浓度最大,硫酸的浓度最小,所以物质的量浓度由大到小的顺序是c>a>b(或c>a=2b),
故答案为:c>a>b(或c>a=2b);
(2)常温下,0.1mol/L的HCl溶液中,C(H+)=10-1mol/L,水电离出的氢离子和氢氧根离子浓度相等,溶液中的氢离子全部是水电离出来的,所以水电离出的C(H+)=c(OH-)=$\frac{{1}^{-14}}{0.1}$mol/l=1×10-13mol/L,
故答案为:1×10-13;
(3)混合溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(A-)+c(OH-)=c(H+)+c(M+),则c(A-)=c(M+),故甲正确,
故答案为:甲;电荷守恒原理;
(4)明矾[KAl(SO4)2•12H2O]作为净水剂是因为明矾溶于水电离出的铝离子发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质,反应的离子方程式为:Al3++3H2O?Al(OH)3(胶体)+3H+;
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(5)FeCl3是强酸弱碱盐,铁离子是弱碱阳离子.将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧氢氧化铁时,氢氧化铁会分解,反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最终得到的是红棕色固体Fe2O3,
故答案为:Fe2O3.
点评 本题考查了弱电解质的电离、盐类的水解应用等知识,题目难度中等,明确盐的水解原理以及弱电解质电离特点是解本题关键,试题知识点较多、综合性较强,充分考查了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
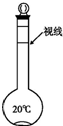 实验室里要配制465mL 0.2mol/L的硫酸钠溶液.
实验室里要配制465mL 0.2mol/L的硫酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
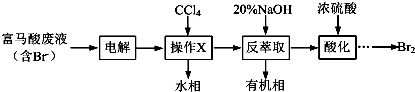
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
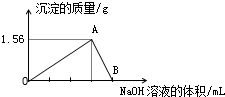 向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
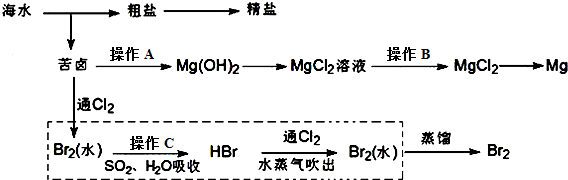
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2O含有的H2O分子数为NA | |
| B. | 1mol金属镁与足量的盐酸完全反应,转移的电子数为2NA | |
| C. | 11.2L氧气含有的O2分子数为0.5NA | |
| D. | 将含1molFeCl3的溶液与沸水完全反应,生成的Fe(OH)3胶体粒子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出,氧化性:Cu2+>Fe3+ | |
| B. | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成该电极为阳极 | |
| C. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果偏低 | |
| D. | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 该溶液中一定含有Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com