
| A、三种物质在常温下溶解度最小的是AgI | B、饱和AgCl溶液中,c(Ag+)≈1.34×10-5mol/L | C、将氯化银置于饱和KI溶液中,固体慢慢会由白色转化为黄色 | D、将浓度均为1×10-6mol/L的AgNO3溶液、KBr溶液等体积混合会生成沉淀 |
| KSP(AgCl) |
| KSP(AgCl) |
| 1.8×10 -10 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:021
已知在25℃时,几种物质的0.1mol/L溶液的电离度如下表:

将足量的锌粒分别放入等体积pH=1的 ①![]() 溶液 ②盐酸 ③醋酸溶液④
溶液 ②盐酸 ③醋酸溶液④![]() 溶液中,放出H2的量关系正确的是
溶液中,放出H2的量关系正确的是
[ ]

查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省杭州市高三第二次月考化学试卷(解析版) 题型:填空题
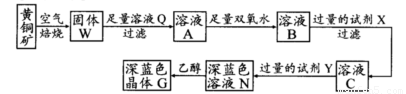
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:

已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:

(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式:???????????????????? ;
(2)试剂X的化学式为??????????????? ;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为?????????????????? ,用pH试纸测该溶液pH值的方法是?????????????????????????????????????????????????? ;
(4)在溶液N中加入乙醇的目的是???????????????????????????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省(六校)高三第一次联考理综化学试卷(解析版) 题型:填空题
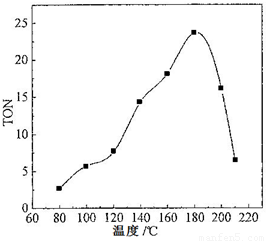
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25℃时,甲醇和DMC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3=_____。
(2)根据反应温度对TON的影响图(下左图)判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是________________________________。
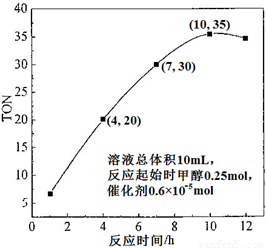
(3)根据反应时间对TON的影响图(上右图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量对TON的影响图(下图),判断下列说法正确的是___ __。
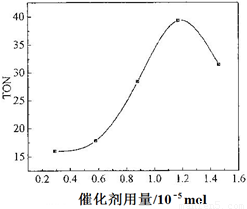
a. 由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b. 在反应体系中添加合适的脱水剂,将提高该反应的TON
c. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省高三年级第一次联考理综化学试卷(解析版) 题型:填空题
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
|
|
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp |
8.0×10-16 |
2.2×10-22 |
4.0×10-38 |
|
完全沉淀pH |
≥9.6 |
≥6.4 |
≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种):
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ;
用pH试纸测该溶液pH值的方法是
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
(5)在溶液N中加入乙醇的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com