
| 1 |
| 2 |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、分别充满HCl、NH3的烧瓶倒置于水中后液面迅速上升,说明二者均易溶于水 | ||||||
B、向NH4HCO3溶液中加过量的NaOH溶液并加热,离子方程式为:NH
| ||||||
| C、用NH4Cl固体和Ca(OH)2固体制备并收集NH3,需要的玻璃仪器有酒精灯、大试管、导管、集气瓶 | ||||||
| D、用湿润的红色石蕊试纸检验氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
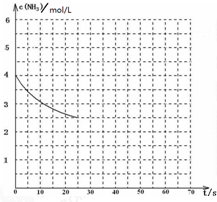 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.| 1 |
| 2 |
| 1 |
| 2 |
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
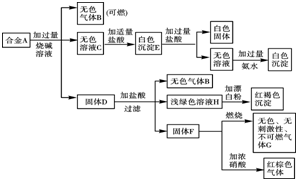 现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示.
现有四种单质组成的合金A,为分析其成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、aNA/25 |
| B、aNA/(25×18) |
| C、aNA/(25×20) |
| D、aNA/(1000×22.4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com