
【题目】I.300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8mol D。
(1)300℃时,该反应的平衡常数表达式为K=___已知K300℃<K350℃,则ΔH___0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为____,D的平均反应速率为___。
(3)若温度不变,缩小容器容积,则A的转化率____(填“增大”“减小”或“不变”)。
II.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。
(已知:2NO2![]() N2O4 ΔH<0)
N2O4 ΔH<0)
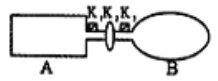
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A)___(填“>”、“<”、“=”)v(B);若打开活塞K2,气球B将___(填“增大”、“减小”、“不变”)。
(2)室温下,若A、B都保持体积不变,将A套上—个绝热层,B与外界可以进行热传递,则达到平衡时,___中的颜色较深。
【答案】![]() > 0.8mol/L 0.2mol/(L·min) 不变 < 减小 A
> 0.8mol/L 0.2mol/(L·min) 不变 < 减小 A
【解析】
I. 3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q
2C(g)+2D(g) ΔH=Q
初始2mol 2mol
反应1.2 0.4 0.8 0.8
2min 0.8 1.6 0.8 0.8
II.关闭K2时,装置A为恒容装置,装置B为恒压装置。
I.(1)K=![]() ;已知K300℃<K350℃,升高温度,K值增大,平衡正向移动,则正反应为吸热反应,则ΔH>0;
;已知K300℃<K350℃,升高温度,K值增大,平衡正向移动,则正反应为吸热反应,则ΔH>0;
(2)在2min末时,B的物质的量为1.6mol,其平衡浓度为1.6mol/2L=0.8mol/L;D的物质的量为0.8mol,v(D)=0.8mol/(2L×2min)=0.2mol/(L·min);
(3)若温度不变,缩小容器容积,增大压强,方程式两边气体的计量数不变,则平衡不移动,A的转化率不变;
II.(1)已知等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同,装置B为等压,相当于装置A平衡后再增大压强,体积减小,c(N2O4)增大,则v(A)< v(B);若打开活塞K2,整个装置为恒压装置,压强增大,平衡正向移动,则总体积减小,A容积不变,则B的体积减小,气球B体积减小;
(2)室温下,将A套上—个绝热层,则A中随反应的进行温度逐渐升高,则平衡逆向移动,c(NO2)增大,颜色比装置B中深。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )

A.在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为92kJ
B.a曲线是加入催化剂时的能量变化曲线,催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
C.催化剂,能增大有效碰撞次数,但不能提高N2的转化率
D.该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
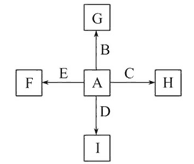
【题目】如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
回答问题:
(1)①中反应的化学方程式为:________________________________________;
(2)1.6 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出离子方程式和计算过程);__________________________________________。
(3)C与过量NaOH溶液反应的离子方程式为:___________________________,反应后溶液与过量化合物I反应的离子方程式为:_________________________;
(4)E在I中燃烧观察到的现象是:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据乙醇的分子结构,回答下列问题:
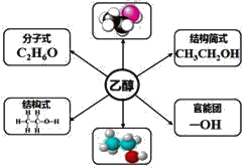
(1)乙醇属于烃的衍生物是因为______________________________________。
(2)羟基为乙醇官能团的原因是___________________________________。
(3)乙醇分子中的碳原子是否都是饱和碳原子___________(填“是”或“不是”)。
(4)乙醇分子中的共价键类型有____________________________________。
(5)乙醇分子中有______种类型的氢原子,它们的数目之比是____________。
(6)一个羟基(─OH)含有______个电子,它是否带有电荷______(填“带”或“不带”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
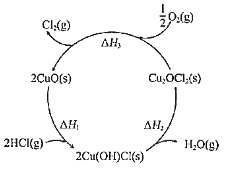
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。请回答:
(1)如图表示在CuO存在下HCl催化氧化的反应过程,则总反应的化学方程为______。
(2)研究HCl催化氧化反应中温度、![]() 和
和![]() 等因素对HCl转化率的影响,得到如下实验结果:
等因素对HCl转化率的影响,得到如下实验结果:
①利用Na2S2O3溶液和KI溶液测定反应生成Cl2的物质的量,若消耗V1mLc1mol·L-1的Na2S2O3溶液,则生成Cl2____________mol(已知2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)。
+2I-)。
②![]() 表示催化剂的质量与HCl(g)流速之比,是衡量反应气体与催化剂接触情况的物理量。当
表示催化剂的质量与HCl(g)流速之比,是衡量反应气体与催化剂接触情况的物理量。当![]() =4、
=4、![]() =50g·min·mol-1时,每分钟流经1g催化剂的气体体积为_____L(折算为标准状况下)。
=50g·min·mol-1时,每分钟流经1g催化剂的气体体积为_____L(折算为标准状况下)。
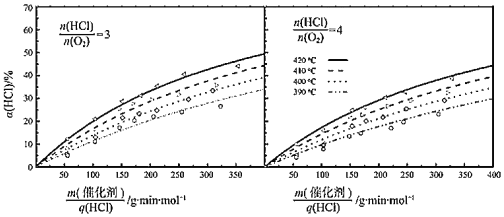
③在420℃、![]() =3、
=3、![]() =200g·min·mol-1条件下,α(HCl)为33.3%,则O2的反应速率为_______mol·g-1·min-1。
=200g·min·mol-1条件下,α(HCl)为33.3%,则O2的反应速率为_______mol·g-1·min-1。
④比较在下列两种反应条件下O2的反应速率:vⅠ_______vⅡ(填“>”“=”或“<”)。
Ⅰ.410℃、![]() =3、
=3、![]() =350g·min·mol-1;
=350g·min·mol-1;
Ⅱ.390℃、![]() =4、
=4、![]() =350g·min·mol-1。
=350g·min·mol-1。
(3)在101.325kPa时,以含N2的HCl和O2的混合气体测定不同温度下HCl催化氧化反应中HCl的平衡转化率,得到如图结果
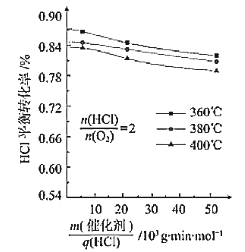
①360℃时反应的平衡常数K360与400℃时反应的平衡常数K400之间的关系是K360_________K400。(填“>”“=”或“<”)。
②一定温度下随着![]() 的增大,HCl的平衡转化率_______(填“增大”“减小”或“不变”),原因为___________________。
的增大,HCl的平衡转化率_______(填“增大”“减小”或“不变”),原因为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法,不正确的是( )
A.ClO2具有强氧化性,可用于自来水的杀菌消毒
B.氮肥包括铵态氮肥、硝态氮肥和尿素
C.电解法冶炼铝时,加入冰晶石可降低氧化铝熔融温度,减少能耗
D.生物炼铜,是指在某些细菌作用下,利用空气中的氧气将不溶性铜矿转化为铜单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() ,25℃时,
,25℃时,![]() 的
的![]() 。该温度下用
。该温度下用![]() 溶液滴定
溶液滴定![]() 溶液的滴定曲线如图所示。下列说法不正确的是( )
溶液的滴定曲线如图所示。下列说法不正确的是( )
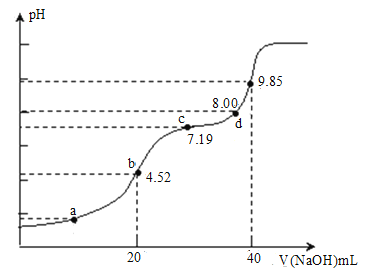
A.若a点溶液c(![]() )=c(H2SO3),则a点对应的
)=c(H2SO3),则a点对应的![]()
B.若选择b为反应终点,宜选择甲基橙为指示剂
C.c点对应的溶液2c(Na+)=3c(![]() )
)
D.d点对应的溶液c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com