

科目:高中化学 来源: 题型:
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl﹣、Br﹣、SO42﹣、HCO3﹣、CO32﹣等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:下列说法错误的是( )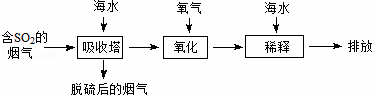
|
| A. | 海水pH约为8的原因主要是天然海水含CO32﹣、HCO3﹣ |
|
| B. | 吸收塔中发生的反应有SO2+H2O⇌H2SO3 |
|
| C. | 氧化主要是氧气将HSO3﹣、SO32﹣、H2SO3氧化为SO42﹣ |
|
| D. | 经稀释“排放”出的废水中,SO42﹣浓度与海水相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B═3C+4D反应中,下面表示的化学反应速率最快的是
A.v(A)=0.5mol/(L•min) B.v(B)=0.05mol/(L•min)
C.v(C)=0.9mol/(L•min) D.v(D)=1.0mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/°C | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”“>”“=”);
(2)830°C时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为________;
(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中各组离子一定能大量共存的是( )
A.使甲基橙呈红色的溶液中:Na+、AlO2- 、NO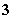 、CO
、CO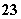
B.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+ 、SO42 -、HCO3- 、Cl-
C.含有0.1 mol·L-1 HCO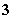 的溶液:Na+、Fe3+、NO
的溶液:Na+、Fe3+、NO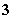 、SCN-
、SCN-
D. =0.1 mol·L-1的溶液:Na+、K+、CO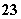 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
在372K时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为 0.02 mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B. 在2s时体系内压强为开始时的1.1倍
C. 在平衡时体系内含有N2O4 0.25 mol
D. 平衡时,N2O4的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容的密闭容器中,可逆反应X(s)+3Y(g)  2Z(g);ΔH>0,达到平衡时,下列说法正确的是( )
2Z(g);ΔH>0,达到平衡时,下列说法正确的是( )
A.充入少量He使容器内压强增大,平衡向正反应方向移动
B.升高温度,平衡向正反应方向移动,平均分子量变小
C.继续加入少量X,X的转化率减小,Y的转化率增大
D.继续加入少量Y,再次平衡时,Y的体积分数比上次平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与有机物结构、性质相关的叙述错误的是( )
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.蛋白质和油脂都属于高分子化合物,一定条件下能水解
C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能使溴的四氯化碳溶液退色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,属于水解反应的是
A.CH3COOH+H2O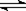 CH3COO-+H3O+ B.CO2+H2O
CH3COO-+H3O+ B.CO2+H2O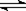 HCO3- +H+
HCO3- +H+
C.CO32-+H2O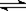 HCO3-+OH- D.HS-+H2O
HCO3-+OH- D.HS-+H2O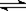 S2-+H3O+
S2-+H3O+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com