
【题目】已知:从石油中获得A是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
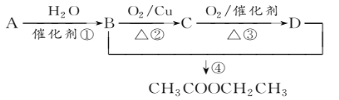
回答下列问题:
(1)写出A的结构简式______________。
(2)B、D分子中的官能团名称分别是_______________、________________。
(3)写出下列反应的反应类型:①_________,②________,④__________。
(4)写出下列反应的化学方程式:
①________________________________________________________________;
②________________________________________________________________。
③________________________________________________________________。
【答案】CH2=CH2 羟基 羧基 加成反应 氧化反应 酯化反应(或取代反应) CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3CH2OH + CH3COOH
2CH3CHO+2H2O CH3CH2OH + CH3COOH![]() CH3COOCH2CH3+ H2O
CH3COOCH2CH3+ H2O
【解析】
由信息可知A为CH2=CH2,结合合成路线图可知,A与水发生加成反应生成B为CH3CH2OH,B发生氧化反应生成C为CH3CHO,C发生氧化反应生成D为CH3COOH,B与D发生酯化反应生成CH3COOCH2CH3,以此解答该题。
(1)由以上分析可知A为CH2═CH2;
答案为:CH2═CH2。
(2)B为CH3CH2OH,B中官能团为羟基,D为CH3COOH,D中官能团为羧基;
答案为羟基、羧基。
(3)反应①的反应类型为加成反应、,②的反应类型为氧化反应,④的反应类型为酯化反应(或取代反应);
答案为加成反应,氧化反应,酯化反应(或取代反应);
(4)①乙烯与水发生加成反应生成乙醇,方程式为CH2═CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
答案为CH2═CH2+H2O![]() CH3CH2OH。
CH3CH2OH。
②乙醇发生催化氧化生成乙醛,方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
答案为2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
③乙酸与乙醇发生酯化反应,方程式为CH3CH2OH + CH3COOH![]() CH3COOCH2CH3+ H2O;
CH3COOCH2CH3+ H2O;
答案为CH3CH2OH + CH3COOH![]() CH3COOCH2CH3+ H2O。
CH3COOCH2CH3+ H2O。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】完成下列各小题。
Ⅰ.按要求书写下列化学方程式
(1)2-甲基-1,3-丁二烯与等物质的量的溴发生1,4-加成的反应:_______。
(2)乙醛与新制氢氧化铜悬浊液加热反应:______。
(3)CH3CHClCOOCH2CH3与氢氧化钠水溶液共热:____。
(4)乙二醇和乙二酸脱水成环酯:_____。
Ⅱ.有一种有机物X的键线式如图所示。
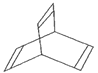
(5)X的分子式为________。
(6)有机物Y是X的同分异构体,且属于芳香族化合物,则Y的结构简式是____。
(7)Y在一定条件下可生成高分子化合物,该反应的化学方程式是___。
(8)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国每年产生的废旧铅蓄电池约330万吨。从含铅废料(含PbSO4、PbO2、PbO等)中回收铅,实现铅的再生,意义重大。一种回收铅的工艺流程如下:
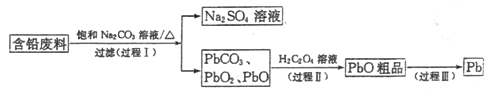
(1)铅蓄电池放电时,PbO2作____极。
(2)过程I,已知:PbSO4、PbCO3的溶解度(20℃)见图l;Na2SO4、Na2CO3的溶解度见如图。
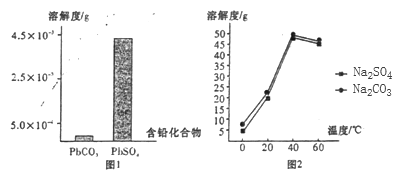
①根据图l写出过程I的离子方程式:__________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据如图,解释可能原因:
i.温度降低,反应速率降低; ii.______________(请你提出一种合理解释)。
(3)①过程Ⅱ,发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑。实验中检测到有大量O2放出,推测PbO2氧化了H2O2,通过实验证实了这一推测。实验方案是___________。
(已知:PbO2为棕黑色固体;PbO为橙黄色固体)
②写出H2O2的电子式__________。
(4)过程Ⅲ,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液,生成Pb,如图。
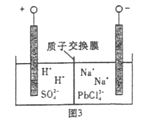
①阴极的电极反应式是____________。
②电解一段时间后,PbCl42-浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_______。
(5)如果用铅蓄电池作电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解其按硫酸浓度为4.5mol/L,当制得26.88L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为________ mol·L-1。(假设电解前后硫酸溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对某未知溶液中离子的检验方法及其结论一定正确的是( )
A.加入稀盐酸产生无色气体,一定含有![]()
B.加入氯化钡溶液产生白色沉淀,一定含有![]()
C.加入碳酸钠溶液产生白色沉淀,一定含有Ca2+
D.取溶液进行焰色反应显黄色,一定含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了科学饮食,了解一些与食品相关的化学知识是必要的。
(1)油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中不应该充入的是________(填序号,下同)。
A.氮气 B.二氧化碳
C.空气 D.氧气
(2)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它________。
A.热稳定性差 B.增加甜味
C.产生二氧化碳 D.提供钠离子
(3)能直接鉴别氯化钠和葡萄糖两种未知浓度溶液的方法是________。
A.观察颜色 B.测量比值
C.加热灼烧 D.分别闻味
(4)苯甲酸钠是常用的食品防腐剂,其结构简式如图。以下对苯甲酸钠描述错误的是________。

A.属于盐类 B.能溶于水
C.属于烃类 D.不易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)________________。
(2)Fe粉除调pH外,另一个作用是___________;Fe粉调节溶液的pH为__________。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为_______________________________;
所得滤液的主要溶质是(填化学式)_______________。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)第2周期的8种元素中,第一电离能介于①元素和③元素间的元素有__种。
(2)表中能形成两性氢氧化物的元素是___(填元素名称![]() ,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式___。
(3)②、⑤、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)___。
(4)④元素与⑩元素两者质子数之差是___。
(5)请写出③的气体氢化物发生催化氧化的化学方程式___。
(6)请写出⑥元素的最高价氧化物的水化物与⑧元素的最高价氧化物的水化物反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构式可用“键线式”简化表示。如CH3一CH=CH一CH3可简写为![]() 。有机物X的键线式为:
。有机物X的键线式为: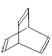 。下列说法不正确的是
。下列说法不正确的是
A.X与苯中碳元素的质量分数相同
B.有机物Y是X的同分异构体,且属于芳香烃,能使溴水褪色,则Y为苯乙烯
C.X能使酸性高锰酸钾溶液褪色
D.X 与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是___。
(2)In的最高价氧化物的水化物的碱性___Ba(OH)2的碱性(填“>”或“<”)。
(3)![]() In的中子数与电子数的差值为___。
In的中子数与电子数的差值为___。
II.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
C.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:___。
(5)A+、B2-、F3+离子半径由大到小的顺序为___(用离子符号表示)。
(6)电子式表示A2B的形成过程___。
(7)含F3+的溶液中通入过量D,反应的离子方程式是___。
(8)A单质与E反应的离子方程式为___,生成的化合物中化学键的类型是___。
III.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(9)Se原子结构示意图可表示为___。
(10)下列说法合理的是___。
a.SeO2既有氧化性又有还原性
b.浓硒酸可能具有强氧化性、脱水性
c.热稳定性:H2Se<HCl<H2S
d.酸性:H2SeO4<HBrO4<HClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com