
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | F | H |
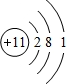 ,故答案为:
,故答案为: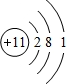 ;
;

科目:高中化学 来源: 题型:
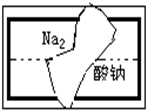 某研究性学习小组在整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶标签破损(如图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出三种猜想,并设计实验验证,写出每一种猜想的实验操作、现象和结论.
某研究性学习小组在整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶标签破损(如图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出三种猜想,并设计实验验证,写出每一种猜想的实验操作、现象和结论.| 猜想的化学物质 | 检验需要的试剂 | 操作、现象和结论 | |
| 1 | |||
| 2 | |||
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
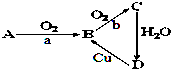 如图为A、B、C、D四种物质的转化关系,a、b为反应条件,
如图为A、B、C、D四种物质的转化关系,a、b为反应条件,查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ |
| B、NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+ |
| C、冷的氢氧化钠溶液中通入氯气:Cl2+2OH-=ClO-+Cl-+H2O |
| D、将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com