
用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1 mol碱式
碳铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH。下列有关叙述不正确的是
A.电解过程产生的气体体积(在标准状况下)为5.6 L
B.电解过程只发生了2CuSO4+2H2O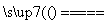 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
C.电解过程转移的电子数为3.612×1023个
D.加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O
科目:高中化学 来源: 题型:
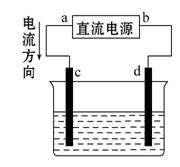 右图是电解NaCl溶液的装置,其中c、d为石墨电极。则下列有关的判断错误的是 ( )
右图是电解NaCl溶液的装置,其中c、d为石墨电极。则下列有关的判断错误的是 ( )
A.a为正极、b为负极
B.c为阳极、d为阴极
C.电解过程中,溶液的碱性逐渐增强
D.电解过程中,将湿润淀粉KI试纸靠近d电极,看到试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质。下列有关说法正确的是 ( )
A.蛋白质中只含C、H、O三种元素
B.糖类发生水解的最终产物都是葡萄糖
C.油脂的主要成分是高级脂肪酸甘油酯
D.糖类、油脂、蛋白质都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定一种气态烃A的化学式,取一定量的A置于一密闭容器中燃烧,定性实验表明产物是CO2、CO 和水蒸气,学生甲、乙设计了两个方案,均认为根据自己的方案能求出A的实验式。他们测得的有关数据如下(箭头表示气流方向,实验前系统内的空气已排尽):
甲:燃烧产物 增重2.52 g
增重2.52 g 增重1.32 g
增重1.32 g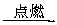 生成CO21.76 g
生成CO21.76 g
乙:燃烧产物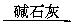 增重5.6 g
增重5.6 g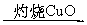 减重0.64 g
减重0.64 g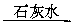 增重4.0 g
增重4.0 g
试回答:
(1)你认为能够求出A的实验式的方案是__________(填“甲”或“乙”),理由是_______________________________________________________________。
(2)根据你选择的方案,通过计算确定A的实验式为_____________________。
(3)若要确定A的化学式_____________(填“需要”或“不需要”)测定其他数据,其原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以NA表示阿伏加德罗常数,下列说法正确的是
A.在标准状况下,11.2 L己烷含有分子数为0.5NA
B.4.2 g乙烯和环丙烷的混合气体含有H原子数为0.6NA
C.甲基﹝-CH3﹞的电子总数为10NA
D.在常温常压下,2.24 L丁烷和2—甲基丙烷的混合气体所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
坚决反对运动员服用兴奋剂,是“人文奥运”的一个基本原则。某一种兴奋剂的结构
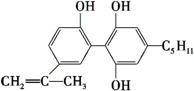 简式为有关该有机物的说法不正确的是
简式为有关该有机物的说法不正确的是
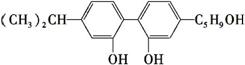
A.它可使酸性高锰酸钾溶液褪色,也能使溴水褪色
B.它属于芳香烃
C.它与不是同分异构体
D.它既可发生加成反应,又可发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图
所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,
生成LiMnO2。回答下列问题:
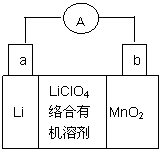 (1)a电极为__________极(填“正”或“负”)。
(1)a电极为__________极(填“正”或“负”)。
(2)电池正极反应式为_______________________。
(3)是否可用水代替电池中的混合有机溶_______
(填“是”或“否”),原因是___________________。
(4)MnO2与双氧水混合化学方程式为 ;
MnO2的作用是 。
(5)MnO2可与KOH和KClO3在高温条件下反应,生
成K2MnO4,反应的化学方程式为_________________________________________,
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键
B.含有共价键的物质一定是共价化合物
C.分子中一定含有化学键
D.含有金属元素的离子一定是阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分子中既有σ键,又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③ B.③④⑤⑥
C.①③⑥ D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com